α-Globin
α-Globin, alpha-Globin, oder Hämoglobin alpha-Kette ist ein Protein aus der Familie der Globine, dessen 142 Aminosäuren lange Polypeptidkette ein Häm als Cofaktor bindet und das so Teil des Proteinkomplexes von Hämoglobinen in Wirbeltieren ist, die Hämoglobin-Untereinheit alpha (HBA1, HBA2).
| Hämoglobin α-Untereinheit | ||
|---|---|---|
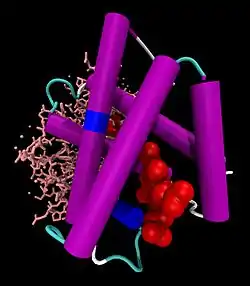
| ||
| Hb-Dimer: vorne α-Untereinheit als Cartoon-Modell mit Häm (rot, als VDW-Modell), hinten β-Untereinheit als Stäbchen, nach PDB 1GZX | ||
|
Vorhandene Strukturdaten: UniProt-Eintrag | ||
| Masse/Länge Primärstruktur | 16'000 Dalton, 141 Aminosäuren | |
| Kofaktor | Häm | |
| Bezeichner | ||
| Gen-Name(n) | HBA1, HBA2 | |
| Externe IDs | ||
| Vorkommen | ||
| Homologie-Familie | Beta-2 Globin | |
| Übergeordnetes Taxon | Wirbeltiere | |
Funktion
Das menschliche Hämoglobin-α1-Gencluster befindet sich auf Chromosom 16, umfasst 30 Kilobasen sowie sieben Loci: 5'- ζ - pseudo-ζ - μ - pseudo-α-1 - α-2 - α-1 - θ - 3'. Die codierenden Sequenzen für α-2 (HBA2) und α-1 (HBA1) sind identisch. Diese Gene unterscheiden sich nur wenig in der 5' nicht-translatierten Region sowie den Introns, aber sie unterscheiden sich signifikant in der 3' nicht-translatierten Region. Zwei α-Ketten plus zwei β-Ketten bilden das Hämoglobin A (HbA), welches im normalen Erwachsenenleben ungefähr 97 % des gesamten Hämoglobins umfasst; α-Ketten in Kombination mit delta-Ketten bilden das HbA-2, welches mit HbF („fetal hemoglobin“) die restlichen 3 % des Hämoglobins von Erwachsenen ausmacht. α-Thalassämie resultiert aus der Deletion eines der α-Gene ebenso wie durch Deletion von sowohl HBA2 als auch HBA1; von einigen α-Thalassämien ohne Deletion wurden bereits berichtet.[1]
Interaktion
α-Globin weist mit β-Globin Protein-Protein-Interaktion auf.[2][3]
Einzelnachweise
- Entrez Gene: HBA1 hemoglobin, alpha 1. Abgerufen am 20. Mai 2012.
- Stelzl U, Worm U, Lalowski M, Haenig C, Brembeck FH, Goehler H, Stroedicke M, Zenkner M, Schoenherr A, Koeppen S, Timm J, Mintzlaff S, Abraham C, Bock N, Kietzmann S, Goedde A, Toksöz E, Droege A, Krobitsch S, Korn B, Birchmeier W, Lehrach H, Wanker EE: A human protein-protein interaction network: a resource for annotating the proteome. In: Cell. 122, Nr. 6, September 2005, S. 957–68. doi:10.1016/j.cell.2005.08.029. PMID 16169070.
- Shaanan B: Structure of human oxyhaemoglobin at 2.1 A resolution. In: J. Mol. Biol.. 171, Nr. 1, November 1983, S. 31–59. doi:10.1016/S0022-2836(83)80313-1. PMID 6644819.
Literatur
- Turbpaiboon C, Svasti S, Sawangareetakul P, et al.: Hb Siam [alpha15(A13)Gly→Arg (alpha1) (GGT→CGT)] is a typical alpha chain hemoglobinopathy without an alpha-thalassemic effect.. In: Hemoglobin. 26, Nr. 1, 2002, S. 77–81. doi:10.1081/HEM-120002944. PMID 11939517.
- Yalçin A, Avcu F, Beyan C, et al.: A case of HB J-Meerut (or Hb J-Birmingham) [alpha 120(H3)Ala→Glu]. In: Hemoglobin. 18, Nr. 6, 1995, S. 433–5. PMID 7713747.
- Giardina B, Messana I, Scatena R, Castagnola M: The multiple functions of hemoglobin.. In: Crit. Rev. Biochem. Mol. Biol.. 30, Nr. 3, 1995, S. 165–96. doi:10.3109/10409239509085142. PMID 7555018.
- Higgs DR, Vickers MA, Wilkie AO, et al.: A review of the molecular genetics of the human alpha-globin gene cluster.. In: Blood. 73, Nr. 5, 1989, S. 1081–104. PMID 2649166.
- Schillirò G, Russo-Mancuso G, Dibenedetto SP, et al.: Six rare hemoglobin variants found in Sicily.. In: Hemoglobin. 15, Nr. 5, 1992, S. 431–7. doi:10.3109/03630269108998862. PMID 1802885.
- Vafa M, Troye-Blomberg M, Anchang J, et al.: Multiplicity of Plasmodium falciparum infection in asymptomatic children in Senegal: relation to transmission, age and erythrocyte variants.. In: Malaria Journal. 7, 2008, S. 17. doi:10.1186/1475-2875-7-17. PMID 18215251. PMC 2267475 (freier Volltext).
- Datta P, Chakrabarty S, Chakrabarty A, Chakrabarti A: Membrane interactions of hemoglobin variants, HbA, HbE, HbF and globin subunits of HbA: effects of aminophospholipids and cholesterol.. In: Biochim. Biophys. Acta. 1778, Nr. 1, 2008, S. 1–9. doi:10.1016/j.bbamem.2007.08.019. PMID 17916326.
- Taylor JG, Ackah D, Cobb C, et al.: Mutations and polymorphisms in hemoglobin genes and the risk of pulmonary hypertension and death in sickle cell disease.. In: Am. J. Hematol.. 83, Nr. 1, 2008, S. 6–14. doi:10.1002/ajh.21035. PMID 17724704.
- Sahu SC, Simplaceanu V, Gong Q, et al.: Insights into the solution structure of human deoxyhemoglobin in the absence and presence of an allosteric effector.. In: Biochemistry. 46, Nr. 35, 2007, S. 9973–80. doi:10.1021/bi700935z. PMID 17691822. PMC 2532491 (freier Volltext).
- Sorour Y, Heppinstall S, Porter N, et al.: Is routine molecular screening for common alpha-thalassaemia deletions necessary as part of an antenatal screening programme?. In: Journal of medical screening. 14, Nr. 2, 2007, S. 60–1. doi:10.1258/096914107781261981. PMID 17626702.
- Hung CC, Lee CN, Chen CP, et al.: Molecular assay of -alpha(3.7) and -alpha(4.2) deletions causing alpha-thalassemia by denaturing high-performance liquid chromatography.. In: Clin. Biochem.. 40, Nr. 11, 2007, S. 817–21. doi:10.1016/j.clinbiochem.2007.03.018. PMID 17512924.
- Ye BC, Zhang Z, Lei Z: Molecular analysis of alpha/beta-thalassemia in a southern Chinese population.. In: Genet. Test.. 11, Nr. 1, 2007, S. 75–83. doi:10.1089/gte.2006.0502. PMID 17394396.
- Dilley J, Ganesan A, Deepa R, et al.: Association of A1C with cardiovascular disease and metabolic syndrome in Asian Indians with normal glucose tolerance.. In: Diabetes Care. 30, Nr. 6, 2007, S. 1527–32. doi:10.2337/dc06-2414. PMID 17351274.
- Fonseka PV, Vasudevan G, Clarizia LJ, McDonald MJ: Temperature dependent soret spectral band shifts accompany human CN-mesohemoglobin assembly.. In: Protein J.. 26, Nr. 4, 2007, S. 257–63. doi:10.1007/s10930-006-9067-7. PMID 17191128.
- Sankar VH, Arya V, Tewari D, et al.: Genotyping of alpha-thalassemia in microcytic hypochromic anemia patients from North India.. In: J. Appl. Genet.. 47, Nr. 4, 2007, S. 391–5. doi:10.1007/BF03194650. PMID 17132905.
- Origa R, Sollaino MC, Giagu N, et al.: Clinical and molecular analysis of haemoglobin H disease in Sardinia: haematological, obstetric and cardiac aspects in patients with different genotypes.. In: Br. J. Haematol.. 136, Nr. 2, 2007, S. 326–32. doi:10.1111/j.1365-2141.2006.06423.x. PMID 17129226.
- Hussein OA, Gefen Y, Zidan JM, et al.: LDL oxidation is associated with increased blood hemoglobin A1c levels in diabetic patients.. In: Clin. Chim. Acta. 377, Nr. 1-2, 2007, S. 114–8. doi:10.1016/j.cca.2006.09.002. PMID 17070510.
- Pan W, Galkin O, Filobelo L, et al.: Metastable mesoscopic clusters in solutions of sickle-cell hemoglobin.. In: Biophys. J.. 92, Nr. 1, 2007, S. 267–77. doi:10.1529/biophysj.106.094854. PMID 17040989. PMC 1697867 (freier Volltext).
- Pistrosch F, Koehler C, Wildbrett J, Hanefeld M: Relationship between diurnal glucose levels and HbA1c in type 2 diabetes.. In: Horm. Metab. Res.. 38, Nr. 7, 2006, S. 455–9. doi:10.1055/s-2006-947838. PMID 16933182.
- Chong YM, Tan JA, Zubaidah Z, et al.: Screening of concurrent alpha-thalassaemia 1 in beta-thalassaemia carriers.. In: Med. J. Malaysia. 61, Nr. 2, 2006, S. 217–20. PMID 16898315.