Mykoplasmen
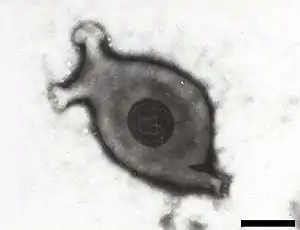
Mycoplasma, deutsch auch als Mykoplasmen bezeichnet (von altgriechisch μύκης mýkēs „Pilz“ sowie πλάσμα plásma „das Geformte“), ist eine Gattung sehr kleiner Bakterien aus der Klasse der Mollicutes (von lateinisch mollis „weich“ und cutis „Haut“, „die Weichhäutigen“). Im Gegensatz zu allen anderen Bakterien fehlt den Mykoplasmen eine Zellwand. Sie leben aerob bis fakultativ anaerob und sind von vielgestaltiger (pleomorpher), veränderlicher, bläschenförmiger Gestalt.[1]
| Mykoplasmen | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Mycoplasma | ||||||||||||
| Nowak 1929 |
Mykoplasmen sind meist parasitär, intra- und extrazellulär lebende Bakterien, die beim Menschen und Wirbeltieren die Ursache für zahlreiche Krankheiten sind. Wenige Arten sind Kommensalen oder opportunistische Krankheitserreger. Die erste Art wurde 1898 von kranken Rindern isoliert und beschrieben. Die häufig beobachteten pilzähnlichen Fadenformen waren namensprägend für die Gattung Mycoplasma. In der Humanmedizin gelang erst 1962 die Zuordnung der Art Mycoplasma pneumoniae zu einer Erkrankung.[1]
Mit einer Größe von 580–1.380 kbp haben die Gattungen Mycoplasma und Ureaplasma das kleinste Genom der zur Auto-Replikation befähigten Prokaryoten mit Ausnahme des Tiefsee-Archaeons Nanoarchaeum equitans (~500 kbp) und des in Blattflöhen lebenden Endosymbionten Carsonella ruddii (etwa 160 kbp). Ihr Genom weist meist einen relativen niedrigen Guanin-Cytosin (GC) Gehalt auf und ihre Zellmembran enthält Cholesterin, das sonst nur bei Eukaryoten gefunden wird.[1][2]
Klassifizierung
Die Gattung Mycoplasma zählt zu der Familie Mycoplasmataceae. Diese Familie wird zu der Klasse Mollicutes innerhalb der Abteilung Tenericutes gestellt.[3]
Ein gemeinsames Merkmal der Klasse Mollicutes (Weichhäuter) und damit auch der Mykoplasmen ist das Fehlen einer Zellwand und die damit einhergehende Anfälligkeit für osmotische Schwankungen des umgebenden Mediums. Antibiotika, die an der Zellwand ansetzen (z. B. Penicilline) sind praktisch unwirksam gegen sie. Aufgrund der geringen Größe der Mykoplasmen lassen sie sich, im Gegensatz zu anderen Bakterien, nicht durch Sterilfilter mit einer nominalen Porengröße von 0,22 µm zurückhalten. Molekular-phylogenetische rRNA-Untersuchungen ergaben, dass die Mollicutes nicht an der Basis des bakteriellen phylogenetischen Baums stehen, sondern vielmehr durch degenerative Evolution aus Gram-positiven Bakterien der Lactobacillus-Gruppe mit einem niedrigen GC-Gehalt der DNA hervorgegangen sind. Im Zuge dieser degenerativen Evolution haben die Mollicutes einen erheblichen Teil ihrer genetischen Information verloren, so dass sie heute zu den Lebewesen mit dem kleinsten bekannten Genom zählen (Mollicutes: 580–2.300 kbp, E. coli: 4.500 kbp, Arabidopsis thaliana: 100.000 kbp, Homo sapiens: 3.400.000 kbp). Bakterien der Klasse Mollicutes leben nicht als freie Bakterien, sondern sind entweder auf eine Wirtszelle oder einen Wirtsorganismus angewiesen.
Als Parasiten oder Kommensalen erhalten sie vom Wirtsorganismus essentielle Stoffwechselkomponenten wie z. B. Fettsäuren, Aminosäuren und Vorstufen der Nukleinsäuren. Die Möglichkeit zur Verkleinerung des Genoms wird auf die parasitäre Lebensweise der Mollicutes zurückgeführt. Für das Wachstum einiger Vertreter der Mollicutes ist auch Cholesterin erforderlich, eine Komponente, die normalerweise nicht in Bakterien gefunden wird und deren Synthesevorstufen ebenfalls von den Wirtszellen zur Verfügung gestellt wird.
Klinisch bedeutsame Mykoplasmen
Mykoplasmen sind als parasitär lebende Bakterien die Ursache für zahlreiche Krankheiten beim Menschen und Wirbeltieren. In der Regel töten Bakterien aus der Klasse der Mollicutes ihren Wirt jedoch nicht ab. Vielmehr verursachen sie chronische Infektionen, was für eine gute Anpassung an die Wirte spricht, und verkörpern damit eine sehr erfolgreiche Art des Parasitismus. Einige Arten sind auch opportunistische Krankheitserreger, wenige Arten wurden auch als harmlose Kommensalen beschrieben, so wurde die Art Mycoplasma cottewii in Gehörgängen und seltener in Nasennebenhöhlen von Ziegen gefunden, eine Pathogenität konnte nicht nachgewiesen werden.[4]
Humanmedizin
- Mycoplasma pneumoniae ist wichtigster Erreger der so genannten „atypischen Pneumonie“. Aber auch Tracheobronchitis, Pharyngitis, Meningitis, Mittelohrentzündungen und weitere Krankheitsbilder können von Mycoplasma pneumoniae verursacht werden. Zudem wird der Organismus mit Störungen des hämatopoetischen (blutbildenden) Systems, des zentralen Nervensystems, der Leber und Bauchspeicheldrüse sowie kardiovaskulären Syndromen in Verbindung gebracht.
- Mycoplasma genitalium ist neben Chlamydia trachomatis ein wichtiger Erreger der so genannten „non-gonococcal-Urethritis“, einer nicht durch Neisseria gonorrhoeae (den sog. „Gonokokken“) verursachten Harnröhren-Entzündung. Anfang 2008 berichtete eine Forschergruppe um Craig Venter, ihr sei es gelungen, erstmals das Erbmaterial eines Bakteriums komplett synthetisch herzustellen. Vorbild für den Nachbau des Genoms sei Mycoplasma genitalium gewesen; der Name des synthetischen Nachbaus ist Mycoplasma genitalium JCVI-syn1.0 (ursprünglich JCVI-1.0).[5][2][6]
- Mycoplasma hominis verursacht z. B. Pyelonephritis, Endometritis und postpartales Fieber[7]
- Mycoplasma fermentans spielt u. a. möglicherweise als ein Faktor bei der Entstehung der Symptome einer HIV-Infektion eine Rolle. Außerdem gibt es Berichte über eine mögliche Beteiligung bei der Entstehung der Symptome des „chronic fatigue syndrome“ (CFS) und dem eventuell auf dem CFS beruhenden „Golfkriegssyndrom“.
Veterinärmedizin
- Mycoplasma mycoides spp. mycoides SC (small colony type) ist Erreger der anzeigepflichtigen Lungenseuche der Rinder. Es ist das erste bekannte Mykoplasma und wurde 1898 durch Edmond Nocard und Émile Roux beschrieben.
- Mycoplasma agalactiae ist Erreger der Infektiösen Agalaktie beim kleinen Wiederkäuer (Schaf, Ziege). Meist kommt es zu einer unbemerkten Euterentzündung mit Milchleistungsrückgang, selten auch zu Gelenks- oder Bindehautentzündungen (Konjunktivitis).
- Mycoplasma bovis verursacht Euterentzündungen mit Milchleistungsrückgang bei Milchkühen und kann bei Kälbern neben Lungenentzündungen auch schwere Gelenksentzündungen auslösen.
- Mycoplasma capricolum ist der Erreger der Lungenseuche der Ziegen.
- Mycoplasma conjunctivae ist der Erreger der Gämsblindheit.
- Mycoplasma felis, eventuell auch Mycoplasma gatae und Mycoplasma feliminutum, sind neben Herpes- und Caliciviren als Erreger am Katzenschnupfen-Komplex beteiligt.
- Mycoplasma gallisepticum ist Erreger von Atemwegserkrankungen beim Geflügel (CRD: chronic respiratory disease beim Huhn und infektiöse Sinusitis bei der Pute). Häufig kommt es zu einer Mischinfektion mit anderen viralen oder bakteriellen Krankheitserregern (z. B.: Coryza contagiosa mit Haemophilus paragallinarum).
- Die sogenannten hämatotrophen Mykoplasmen verursachen bei Katzen (Mycoplasma haemofelis, Mycoplasma haemominutum und Mycoplasma turicensis, s. Feline infektiöse Anämie), Hunden (Mycoplasma haemocanis) und Schweinen (Mycoplasma suis, s. Eperythrozoonose der Schweine) Anämien. Sie wurden früher zu den Rickettsien gezählt.
- Mycoplasma hyopneumoniae verursacht die Enzootische Pneumonie der Schweine
- Mycoplasma hyorhinis und Mycoplasma hyosynoviae sind die Erreger der Mykoplasmenarthritis und -polyserositis der Schweine
- Mycoplasma pulmonis ist der Erreger der Mykoplasmose der Ratte, der häufigsten Erkrankung der oberen Atemwege bei als Heim- oder Labortier gehaltenen Wanderratten.
Zellkultur
Neben ihrer klinischen Bedeutung sind Mykoplasmen (hauptsächlich Mycoplasma orale) auch die gefährlichsten Kontaminationen in der normalen Zellkultur. Da man sie lichtmikroskopisch nicht sehen kann und sie gegen Standardantibiotika resistent sind, bleiben sie oft unerkannt und beeinflussen so das zelluläre Wachstum und die Ergebnisse.
Minimalgenom und synthetische Biologie
Ein 2010 von Craig Venter und Kollegen vom JCVI chemisch synthetisiertes Genom einer Mycoplasma-Zelle, das vollständig auf synthetischer DNA basiert und sich selbst replizieren kann, wurde als ‚Mycoplasma laboratorium‘ (Arbeitstitel, kein Taxon) bezeichnet.[8] Am 24. März 2016 veröffentlichte das JCVI Ergebnisse, wonach er ein synthetisches Bakterium Mycoplasma mycoides JCVI-syn3.0 mit 473 Genen, beziehungsweise 531.000 Basenpaaren, geschaffen hat, die es benötigt, um alle lebenswichtigen Prozesse durchzuführen (Minimalgenom).[9][10]
Probenentnahme, Transport und Nachweis
Aufgrund einer fehlenden bakteriellen Zellwand sind die Mykoplasmen in Proben und Untersuchungsmaterialien sehr empfindlich gegenüber Austrocknung. Proben an Tupfern müssen daher schnell weiterverarbeitet werden oder in ein Transportmedium[11] eingebracht werden. Mykoplasmen in Gewebe- und Sputumproben können unbehandelt transportiert werden. Ein Intervall von 24 bis 48 Stunden zwischen Probenentnahme und Probenanalyse kann mit Kühlung auf +4 °C überbrückt werden. Auch das Einfrieren der Proben auf −70 °C ist möglich.[1] Da Mykoplasmen keine Zellwand haben, können sie nur auf speziellen Nährböden angezüchtet werden. Deshalb hat sich als schnelle und billige Standardmethode die Polymerase-Kettenreaktion (PCR) zum Nachweis etabliert. Dies gilt aber nicht für alle Mykoplasmen.
Literatur
- Marianne Abele-Horn: Antimikrobielle Therapie. Entscheidungshilfen zur Behandlung und Prophylaxe von Infektionskrankheiten. Unter Mitarbeit von Werner Heinz, Hartwig Klinker, Johann Schurz und August Stich, 2., überarbeitete und erweiterte Auflage. Peter Wiehl, Marburg 2009, ISBN 978-3-927219-14-4, S. 219. f.
- Martin Dworkin, Stanley Falkow, Eugene Rosenberg, Karl-Heinz Schleifer, Erko Stackebrandt (Hrsg.): The Prokaryotes. A Handbook on the Biology of Bacteria. 3. Auflage, Band 4: Bacteria: Firmicutes, Cyanobacteria. Springer, New York, NY 2006, ISBN 978-0-387-25494-4 (englisch: Print-Ausgabe), ISBN 978-0-387-30744-2 (Online-Ausgabe), doi:10.1007/0-387-30744-3.
- Otto Gsell, U. Krech, Werner Mohr (Hrsg.): Klinische Virologie. Einschließlich Chlamydien, Coxiellen und Mykoplasmen. Fortschritte in Diagnostik, Therapie und Prophylaxe. Urban und Fischer, München 1991, ISBN 3-541-12201-3.
- Irmgard Gylstorff, J.. M. Bové: Infektionen durch Mycoplasmatales, Enke, Stuttgart 1985, ISBN 3-432-94881-6 (Lizenzausgabe des Gustav Fischer Verlags Jena).
- Shmuel Razin, Joseph G. Tully (Hrsg.): Molecular and Diagnostic Procedures in Mycoplasmology. Band 1: Molecular Characterization. Academic Press, San Diego, CA / London 1995. ISBN 0-12-583805-0 (englisch).
Anmerkungen
- Henning (Hrsg.) Brandis unter Mitarb. von R. Ansorg Brandis: Lehrbuch der medizinischen Mikrobiologie : 192 Tabellen, 7., völlig neubearb. Aufl.. Auflage, G. Fischer, Stuttgart [u. a.] 1994, ISBN 3437007432, S. 66, 172, 610ff.
- Caroline Ring: Die Jagd nach dem Minimalgenom, auf: spektrum.de vom 7. April 2016
- Systematik nach J.P. Euzéby: List of Prokaryotic Names with Standing in Nomenclature – Stand: 15. September 2018
- George M. Garrity: Bergey’s Manual of Systematic Bacteriology. Band 5: The Bacteroidetes, Spirochaetes, Tenericutes (Mollicutes), Acidobacteria, Fibrobacteres, Fusobacteria, Dictyoglomi, Gemmatimonadetes, Lentisphaerae, Verrucomicrobia, Chlamydiae, and Planctomycetes. Springer, New York 2011, ISBN 978-0-387-95042-6.
- Daniel G. Gibson et. al.: Complete Chemical Synthesis, Assembly, and Cloning of a Mycoplasma genitalium Genome. In: Science. Band 319, Nr. 5867, 2008, S. 1215–1220, doi:10.1126/science.1151721. Siehe dazu:
- netzeitung.de (Memento vom 6. Januar 2010 im Internet Archive): Venter präsentiert künstliches Bakterien-Genom.
- Roy D Sleator: The story of Mycoplasma mycoides JCVI-syn1.0 – The forty million dollar microbe, in: Bioeng Bugs 1(4), Juli-August 2010, S. 229–230, online 24. Mai 2010, doi:10.4161/bbug.1.4.12465, PMC 3026460 (freier Volltext). PMID 21327053
- Marianne Abele-Horn: Antimikrobielle Therapie. Entscheidungshilfen zur Behandlung und Prophylaxe von Infektionskrankheiten. Unter Mitarbeit von Werner Heinz, Hartwig Klinker, Johann Schurz und August Stich, 2., überarbeitete und erweiterte Auflage. Peter Wiehl, Marburg 2009, ISBN 978-3-927219-14-4, S. 219 f.
- Gibson DG, Glass JI, Lartigue C, Noskov VN, Chuang RY, Algire MA, Benders GA, Montague MG, Ma L, Moodie MM, Merryman C, Vashee S, Krishnakumar R, Assad-Garcia N, Andrews-Pfannkoch C, Denisova EA, Young L, Qi ZQ, Segall-Shapiro TH, Calvey CH, Parmar PP, Hutchison CA, Smith HO, Venter JC: Creation of a bacterial cell controlled by a chemically synthesized genome. In: Science. 329, Nr. 5987, Juli 2010, S. 52–56. bibcode:2010Sci...329...52G. doi:10.1126/science.1190719. PMID 20488990.
- Leben auf niedrigster Stufe: Genforscher Craig Venter erschafft künstliche Minimalzelle. Deutschlandfunk, 24. März 2016, abgerufen am 26. März 2016.
- Was das Leben braucht. Telepolis, 26. März 2016, abgerufen am 1. April 2016.
- Z. B. Rindertrypticase-Soja-Brühe mit 0,5 % Rinderalbumin und Penicillin G)