Entwicklung von Einzellern zu Vielzellern
Von den grundlegenden Entwicklungslinien der Domäne der Eukaryoten haben die meisten ausschließlich einzellige Vertreter hervorgebracht. Diese wurden früher, als man sich über ihre grundlegende Verschiedenheit noch nicht klar war, als „Protisten“ zusammengefasst. Von den mindestens etwa 120 größeren Kladen (vgl.[1][2][3]) enthalten nur 36 Gruppen, die (zumindest in einigen bis vielen ihrer Arten) mehrzellige Verbände aufbauen. Dabei handelt es sich meist um einfache Zellfäden bzw. flächige oder kugelige Ansammlungen, die als Zellkolonien bezeichnet werden. Sie bestehen in der Regel aus untereinander gleich differenzierten Zellen, gelegentlich kommen zwei (selten drei) verschiedene Zelltypen vor. Höherentwickelte, echte mehrzellige Organismen, die durch den Besitz zahlreicher unterschiedlicher Zelltypen gekennzeichnet sind, die sich zu komplexen Geweben zusammenschließen, existieren in sechs Entwicklungslinien:
- vielzellige Tiere (Metazoa)
- Landpflanzen (Embryophyta)
- Rotalgen der Klasse Florideophyceae
- Braunalgen („Tange“) der Ordnung Laminariales
- Ständerpilze (Basidiomycetes)
- Schlauchpilze (Ascomycetes)
Der Übergang zur vielzelligen Lebensweise wurde in jeder dieser Linien auf eine jeweils einmalige Weise unabhängig von den anderen erreicht.
Auch in den übrigen etwa 30 Entwicklungslinien mit einfacheren mehrzelligen Vertretern sind mehrzellige Verbände, nach aktuellem Stand der Forschung über die Verwandtschaftsverhältnisse, mindestens 22-mal unabhängig voneinander entstanden[4]. Dies legt nahe, dass es innerhalb der Evolution eine gewisse Tendenz zur Viel- und Mehrzelligkeit gibt[5]. Nach wie vor sind jedoch auch heute einzellige Organismen nicht nur vorhanden; sie besitzen im Gegenteil eine große Dichte und Artenfülle, ohne dass eine Tendenz zu ihrer Verdrängung durch Viel-/Mehrzeller bestände. Während die Tiere und die Landpflanzen ausschließlich vielzellige Organismen umfassen, existieren in allen anderen Linien bis heute alle Übergänge von Einzellern über einfache Kolonien und Verbände bis hin zu echten Vielzellern nebeneinander. Dies wäre nicht möglich, wenn das Organisationsniveau der Vielzeller in allen Belangen und unter allen Bedingungen unzweifelhaft überlegen wäre.
Mehrzeller: Kriterien und Voraussetzungen
Die Entstehung einfacher mehrzelliger Kolonien und Aggregate („Cluster“) ist evolutiv leicht erreichbar. Tatsächlich ließ sie sich im Labor an einem Modellorganismus, einem einzelligen Laborstamm der Backhefe (Saccharomyces cerevisiae) durch geeigneten Selektionsdruck binnen weniger Generationen künstlich erzeugen[6]. Die Entwicklung komplexerer mehrzelliger Lebensformen mit differenzierten Zellen setzt hingegen die Lösung zahlreicher Probleme voraus.
- Alle sexuell fortpflanzenden Mehrzeller gehen in ihrem Entwicklungszyklus auf ein einzelliges Stadium, eine Eizelle, zurück.[7] Alle Zellen sind also, von sekundären Mutationen abgesehen, genetisch identische Klone. Bei der Zelldifferenzierung werden nur noch wenige Zellen zur tatsächlichen Fortpflanzung reserviert, die übrigen gehen mit dem Organismus, den sie bilden, zugrunde. Sie müssen sich also altruistisch verhalten, indem sie zum Wohle ihrer Verwandtschaft auf eigene Fortpflanzung verzichten.
- Die Zellen eines vielzelligen Organismus müssen ihr Verhalten, ihre Differenzierung und ihre Vermehrungsrate koordinieren, damit ein Organismus überhaupt entstehen und funktionieren kann. Dafür ist ein Kommunikationssystem zwischen den Zellen erforderlich.
- Damit der Organismus überhaupt physisch Bestand haben kann, müssen die Zellen sich zu Zellverbänden zusammenschließen. Dazu benötigen sie Mechanismen zum Zellkontakt und zur Haftung.
- Alle mehrzelligen Organismen bestehen neben dem Zellgewebe aus einer von den Zellen abgeschiedenen, extrazellulären Matrix. Diese muss in koordinierter Weise von den Zellen produziert werden können.
Diese Voraussetzungen gelten im Prinzip für alle mehrzelligen Organismen. Für höher entwickelte Vielzeller sind darüber hinaus weitere Adaptationen notwendig. Diese sind aber für den Übergang zum vielzelligen Leben zunächst bedeutungslos, sie werden erst bei der Zunahme der Größe und Komplexität bereits vielzelliger Organismen wichtig:
- Differenzierte und arbeitsteilig arbeitende Zellverbände setzen voraus, dass einige Zellen auf eine unabhängige Nahrungsaufnahme verzichten müssen. Diese müssen also von anderen miternährt werden. Dazu sind interzelluläre Transporteinrichtungen erforderlich.
- Höher entwickelte Vielzeller schließen sich durch Deckgewebe (Epithelien) von ihrer Umwelt ab und bilden so ein internes Milieu aus. Damit bieten sie den im Inneren liegenden Zellen gleichmäßigere, abgepufferte Lebensbedingungen. Diese Zellen müssen aber nun durch weitere Transporteinrichtungen z. B. mit Sauerstoff versorgt werden.
- Höher entwickelte Vielzeller bilden zahlreiche unterschiedliche Zelllinien aus, obwohl das Erbgut in allen ihren Zellen gleich ist. Sie benötigen also eine komplexe Steuerung der Entwicklung und Differenzierung.
Vorteile und Nachteile einfacher Vielzeller
Vielzeller sind evolutiv immer aus Einzellern hervorgegangen. Die entstandenen, ersten Vielzeller müssen dementsprechend zunächst sehr einfach strukturierte, recht kleine Organismen gewesen sein, die zunächst auch nicht allzu viele verschiedene Zelltypen besessen haben können. Damit dieses Stadium entstehen und von der Evolution ausgelesen werden konnte, muss es jeweils einen Selektionsvorteil gegenüber seinen unmittelbaren einzelligen Verwandten besessen haben. Für diese Betrachtung sind die Vorzüge großer, hochdifferenzierter Vielzeller völlig bedeutungslos. Da der historische Übergang zum Vielzeller vor sehr langer Zeit (bei allen komplexen Vielzellern bereits im Präkambrium) abgelaufen ist, sind für den Vergleich vor allem heute lebende kleine, wenig differenzierte Vielzeller im Vergleich mit ihren einzelligen Verwandten wichtig.
Folgende Vorteile wurden für einfache Vielzeller dokumentiert: Sie sind gegenüber einer Reihe von Fressfeinden (Prädatoren) besser geschützt, zum Beispiel einzelligen Prädatoren oder solchen mit filtrierender Ernährungsweise.[8] Die Grünalge Scenedesmus acutus lebt z. B. im Labor meist als Einzeller, im Freiland als Zellkolonie. Es konnte gezeigt werden, dass Präsenz von Daphnien („Wasserflöhen“) als Fressfeinden im selben Wasserkörper den Übergang zur Koloniebildung auslöst.[9] Sie können Nährstoffe wie z. B. Phosphat effektiver für Not- und Mangelzeiten speichern (z. B. Volvox[10]).
Den Vorteilen stehen aber auch einige bedeutsame Nachteile von vielzelligen Organismen gegenüber. Dies betrifft insbesondere die einfachen und ersten, noch wenig differenzierten Vielzeller. Durch Klärung der Verwandtschaftsverhältnisse konnte z. B. bei den Verwandten der Grünalge Volvox in der Tat aufgezeigt werden, dass mehrfach aus vielzelligen Linien wieder einfacher strukturierte, oder sogar Einzeller, hervorgegangen sind. Zunächst besteht für die Zellen eines neu entstehenden Vielzellers dasselbe Problem, das sich auf einer anderen Organisationsebene für soziale Tierarten stellt. Wenn einige Zelllinien die direkte Vermehrung zugunsten von Keimzellen aufgeben, verhalten sie sich altruistisch, das heißt, sie nehmen für sich selbst Nachteile in Kauf, die anderen Zellen zugutekommen. Altruistische Systeme sind immer durch „Betrüger“ bedroht, die die Vorteile ausnutzen, ohne selbst etwas beizutragen. In höher entwickelten Zellverbänden geben die einzelnen Zellen quasi ihre Individualität zugunsten des neu entstehenden Organismus auf.[11] Unabhängige Vermehrung kommt hier nur noch pathologisch (als Krebs) vor; dieser tritt, in verschiedener Form, bei allen Vielzellern aus fast allen evolutiven Linien auf (ist also nicht etwa auf die Wirbeltiere mit dem Menschen beschränkt).[12] Bei einfacher strukturierten Vielzellern, deren Zellen ggf. auch allein lebensfähig wären oder die imstande wären, anstelle der Keimzellen ebenfalls lebensfähigen Nachwuchs hervorzubringen, setzt die altruistische Aufgabe der eigenen Vermehrung entsprechende Vorteile für andere (in der Regel nahe verwandte) Träger desselben Erbguts voraus. Ein weiterer Nachteil eines größer werdenden Organismus ist es, dass die einfache Verteilung von Stoffen durch Diffusion zur Versorgung aller Zellen nicht mehr ausreichen kann, deshalb sind besondere, ggf. aufwändige Transporteinrichtungen neu zu entwickeln.[13]
Wie war es also möglich, dass vielzellige Organismen entstehen konnten, wenn sie zunächst gegenüber Einzellern nur wenige Selektionsvorteile besessen haben, und ihre Höherentwicklung von zahlreichen evolutiven Neuerungen abhängig war, ohne die sie diese Vorteile gar nicht realisieren konnten? Dabei scheint es sich um ein klassisches „Henne-Ei-Problem“ zu handeln. Zur Klärung dieser Frage werden heute lebende, einfache und kaum differenzierte Vielzeller bzw. ihre einzellig gebliebenen Verwandten als Modellorganismen untersucht. Klassische Modellorganismen für die Evolution vielzelliger Lebensformen, wie z. B. die Grünalge Volvox, der zelluläre „Schleimpilz“ Dictyostelium discoideum oder das koloniebildende Kragengeißeltierchen Monosiga brevicollis werden unten näher vorgestellt. Abgekürzt, kann die Lösung des Rätsels so zusammengefasst werden: Zahlreiche Adaptationen, von denen man klassisch annahm, sie wären nur bei Vielzellern vorhanden und sinnvoll und hätten deshalb von diesen neu entwickelt werden müssen, waren tatsächlich bei Einzellern schon vorhanden, dies wird Präadaption oder auch Exaptation genannt. Dadurch war die Hürde zur Entstehung der Vielzeller niedriger als lange gedacht.
Tod und Zelltod
Als wesentlicher Unterschied zwischen Einzellern und Vielzellern gilt es, dass in Vielzellern nur noch bestimmte Zellen, die Keimzellen, an der Vermehrung beteiligt sind. Die übrigen Zellen (somatische Zellen genannt, von griechisch σῶμα soma „Körper“) gehen mit dem Organismus zugrunde. Neben dem Tod des Individuums, der eine Leiche zurücklässt, und teilweise als Ursache dafür, sind auch individuelle Zellen eines Vielzellers nicht unbegrenzt lebens- und teilungsfähig. Ihr Leben endet häufig aktiv durch eine Art eingebautes „Selbstmordprogramm“ mit einem programmierten Zelltod, meist in Form der Apoptose. Viele Zellen erfüllen im Organismus ihre Rolle sogar ausschließlich im abgestorbenen Zustand, wie z. B. das Wasserleitgewebe (Xylem) der Landpflanzen oder die verhornten Zellen der Oberhaut, von Haaren und Hörnern von Wirbeltieren. Einzeller gelten hingegen als „potenziell unsterblich“. Ihr Leben endet nicht durch Alterung und Tod, sondern durch eine Zellteilung in (normalerweise) zwei Tochterorganismen, ansonsten nur durch Feinde oder Unfälle.
Neuere Forschungen haben nun erwiesen, dass auch Einzeller sterben können, also nicht zwingend potenziell unsterblich sind, wie die vereinfachende Sichtweise nahelegte[14][15][16]. Dies gilt sogar schon für Prokaryoten[17]. Die dabei verwendeten Enzyme, die Caspasen (bei Pflanzen: Metacaspasen) sind bei vielen Einzellern homolog zu denjenigen der Mehrzeller[14], und auch die übrigen Mechanismen besitzen, soweit schon bekannt, homologe Bildungen bei Vielzellern. Zumindest in einigen Fällen wurde der Mechanismus wohl durch horizontalen Gentransfer erworben, was eine Interpretation der tatsächlichen zeitlichen Abfolge schwierig macht. Es gilt aber heute als hoch wahrscheinlich, dass der grundlegende Mechanismus älter ist als vielzellige Lebensformen. Ausgelöst wird das Selbstmordprogramm durch Signale von Artgenossen, es handelt sich also um eine Form von koordiniertem Verhalten in Gruppen oder Kolonien von Einzellern.
Über den biologischen Sinn des programmierten Zelltods in Einzellern sind verschiedene Hypothesen aufgestellt worden. Er tritt häufig bei oxidativem Stress oder unter Nährstoffmangelbedingungen ein. Möglicherweise dient er so dazu, Artgenossen (aufgrund des klonalen Wachstums in der Regel nahen Verwandten) Nährstoffe zukommen zu lassen, wenn die Bedingungen für die eigene Fortpflanzung nicht mehr ausreichen[16]. Dieser Zusammenhang ist aber spekulativ und in einzelnen Fällen ist bisher noch kein überzeugender Vorteil gefunden worden[15]. Wahrscheinlich spielt, ähnlich wie bei Vielzellern, auch die Abwehr von Pathogenen und Infektionen eine Rolle[17].
Adhäsion
Damit ein potenzieller Vielzeller nicht einfach auseinanderfällt, sind Brücken oder Bindungen zwischen seinen Zellen erforderlich (vgl. unter Zellkontakt). Dieser Vorgang wird Adhäsion genannt.
Adhäsionsmechanismen sind prinzipiell verschieden zwischen Organismen, deren Zellen eine Zellwand ausbilden, und solchen mit „nackten“ Zellen. Mehrzeller mit Zellwand „kleben“ ihre Zellwände meist mit Polysacchariden wie Pektinen oder Hemicellulosen aneinander. Direkter Kontakt zwischen den Zellen wird durch Lücken in der Wand (sog. Tüpfel) über Plasmodesmata genannte Verbindungen erzeugt. Bei mehrzelligen Rotalgen werden nach ähnlichen Prinzipien, aber im Detail auf völlig andere Weise, sog. „pit connections“ ausgebildet[4], ähnliche Poren (pits) finden sich zwischen Pilzzellen.
Tierzellen stellen Zellkontakte im Wesentlichen über Membranproteine her. Diese durchspannen entweder die Zellmembran und stehen dann mit Elementen des Zytoskeletts in direktem Kontakt, oder sie sind über sogenannte GPI-Anker (mit der Substanz Glycosylphosphatidylinositol) in der Membran verankert[18]. Die Adhäsionsmoleküle von Tieren lassen sich in fünf Familien gliedern, die Cadherine, Integrine, Selectine, Proteoglykane und Immunoglobulin-artigen. Durch die vollständige Entzifferung des Genoms des Einzellers Monosiga brevicollis, eines Vertreters der Kragengeißeltierchen, die als nächste Verwandte der vielzelligen Tiere erkannt worden sind[19], wissen wir, dass die meisten davon den vielzelligen Tieren und ihren einzelligen Verwandten gemeinsam sind. Dies ist hier nur dadurch erklärbar, dass sie in der Evolution schon entstanden sind, bevor sich die ersten vielzelligen Tiere entwickelt haben. Monosiga verfügt über 23 Cadherine, 17 Integrine (alle mit alpha-Untereinheit), 5 Immunglobuline und 12 sog. C-Typ Lectine[20]. Es ist also nicht nur ein Adhäsionsmolekül, sondern bereits eine ganze Batterie von solchen vorhanden. Die genaue biologische Aufgabe dieser Moleküle bei Monosiga ist dabei noch ungeklärt. Es erscheint aber hoch wahrscheinlich, dass sie auch bei ihm in irgendeiner Form mit Zellkontakten zu tun hat.
Zu den am einfachsten strukturierten vielzelligen Tieren, deren Zellen auffallende Gemeinsamkeiten zu den einzelligen Kragengeißeltierchen aufweisen, gehören die Schwämme. Aus Experimenten, die teilweise schon im 19. Jahrhundert durchgeführt wurden, ist bekannt, dass sich Zellverbände von Schwämmen spontan regenerieren können, wenn die Zellen vorher vereinzelt wurden – zum Beispiel, indem der Organismus durch ein Sieb gestrichen wurde. Als wesentliche Adhäsionsmoleküle, die diese Organisation bewerkstelligen, wurden komplexe Proteoglycane identifiziert[21].
Signale
Die Kommunikation der Zellen in vielzelligen Organismen (vgl. unter Signaltransduktion) ist Voraussetzung für fast jede Form mehrzelligen Lebens. In Vielzellern sind Adhäsion und Signalaustausch häufig verbunden und werden oft durch dieselben Moleküle vermittelt.
Einfachste Vielzeller kommen mit wenig Signalaustausch aus. So ist bei der Grünalge Volvox rousseletii für das Schwimmen zum Licht, das koordinierte Arbeit der Geißeln aller Zellen des kugeligen Zellverbands voraussetzt, kein direkter Signalaustausch notwendig[22]. Hier reagiert jede Zelle unabhängig auf den Lichteinfall. Durch die unterschiedliche Größe und Lichtempfindlichkeit der Zellen am Vorder- und Hinterende resultiert eine einfache Koordination der Bewegung. Aber auch die Zellkolonien von Volvox, die neben den Geschlechtszellen nur aus einem einzigen Zelltyp bestehen, kommen nicht ganz ohne Kommunikation aus. So haben sie spezielle Cycline (vom Typ D) entwickelt, die die Zellvermehrung und Fortpflanzung koordinieren[23].
In mehrzelligen Tieren ist eine wesentliche Klasse von Signalmolekülen die Tyrosinkinasen. Deren Entwicklung galt daher lange Zeit als ein Schlüsselmerkmal vielzelliger Tiere. Aus der Entschlüsselung des Erbguts des Kragengeißeltierchens Monosiga brevicollis ist nun klar geworden, dass dieser nicht nur ebenfalls über Tyrosinkinasen verfügt, sondern sogar eine größere Vielfalt an Familien dieser Enzyme besitzt als alle Metazoa[24]. Die meisten davon besitzen keine direkten Orthologa in Vielzellern, sind also wohl (auf derselben Grundlage) konvergent entwickelt worden[25]. Über die spezielle Rolle der Tyrosinkinasen bei Monosiga ist noch nicht viel bekannt, bisherige Indizien deuten auf Signalaustausch hin. So erreichten Zellkulturen der Art bei Hemmung der Kinasen nur noch eine weitaus geringere Dichte[26].
Extrazelluläre Matrix
Alle Vielzeller bestehen nicht ausschließlich aus Zellen. Ein großer Teil des Organismus wird durch Substanzen gebildet, die von Zellen in hoch koordinierter Art nach außen abgeschieden werden. Diese extrazelluläre Matrix ist sowohl bei einfach gebauten, wenig differenzierten Vielzellern wie auch bei komplexen hochdifferenzierten Organismen von großer Bedeutung. Gerade einfache, wenig differenzierte Vielzeller erhalten durch sie Form und Gestalt. So besteht die kugelige Zellkolonie der Grünalge Volvox zu 99 Prozent aus extrazellulärer Matrix[23]. Einfach strukturierte mehrzellige Tiere erhalten ihre Struktur ebenfalls durch sie. Der geleeartige Schirm oder der Polyp eines Nesseltieres oder einer Rippenqualle besteht im Wesentlichen aus zellfreier Substanz (Mesogloea), durch die dünne Lagen (Epithelien) aktiver Zellen in Form gehalten werden. Auch der Körper eines Schwamms wird vor allem von zellfreier Matrix (hier Mesohyl genannt) gebildet, (er ist das, was beim echten Badeschwamm vom Organismus im genutzten Zustand übrig bleibt). Zusätzlich scheiden Skleroblasten genannte Zellen bei den meisten Schwämmen kalkige oder kieselige Skelettnadeln (Spiculae) ab.
Solche Abscheidungen sind auch bei einzelligen Organismen weit verbreitet. Sie umfassen Enzyme zur Nahrungsaufschließung (z. B. Invertasen, Proteasen, Siderophore), Toxine und Antibiotika, aber auch Strukturmoleküle, die ihnen z. B. helfen, sogenannte Biofilme auf Oberflächen aller Art auszubilden[27]. Selektiv kann dies dadurch aufrechterhalten werden, dass z. B. alle Beteiligten von vergrößerten Aggregationen etc. profitieren und dass Nachbarn unter Mikroorganismen aufgrund des klonalen Wachstums mit hoher Wahrscheinlichkeit nahe Verwandte sein werden (vgl. unter Verwandtenselektion). Bei Siderophoren-produzierenden Eisenbakterien konnte aber gezeigt werden, dass sich auf längere Sicht nicht selten „Betrüger“, die selbst nichts beitragen, in der Population auf Kosten ihrer altruistischen Verwandten durchsetzen können. Unter dafür ungünstigen Bedingungen leidet dann allerdings das Wachstum der ganzen Kolonie gegenüber dem kooperativen Typ.
Zelltypen
Die einfachsten mehrzelligen Organismen bestehen aus untereinander völlig gleichartigen Zellen. Einfache Zelldifferenzierungen treten aber bereits bei Prokaryoten auf. Das Cyanobakterium („Blaualge“) Nostoc bildet einfache Zellfäden aus miteinander verbundenen Zellen aus. Eingestreut in den Faden sind dickwandige Zellen mit abweichender Morphologie, die Heterozysten genannt werden. Ihre Aufgabe ist die Stickstofffixierung aus molekularem Stickstoff aus der Luft, deren Schlüsselenzym Nitrogenase sauerstoffempfindlich ist. Heterocysten müssen von den photosynthetisch aktiven Zellen mit Assimilaten versorgt werden und versorgen diese ihrerseits mit Stickstoffverbindungen.[8] Differenzierte Mehrzelligkeit wird auch bei sporenbildenden Myxobakterien, z. B. dem viel untersuchten Myxococcus xanthus, beobachtet. Sie ist aber bei Prokaryoten generell selten. Sicherlich nicht zufällig weisen die mehrzelligen Vertreter signifikant größere Genome auf als ihre einzellig bleibenden Verwandten. Das proteincodierende Genom von Myxococcus xanthus gehört zu den größten bekannten aller Prokaryoten und übertrifft darin sogar einige einfache Eukaryoten[28].
Vielzellige Tiere[29] besitzen mehr unterschiedliche Zelltypen. Die geringste berichtete Anzahl ist vier (möglicherweise fünf) beim einfachsten Vielzeller Trichoplax adhaerens[30]. Die meisten Metazoa besitzen zwischen 10 und 25 verschiedene Zelltypen[31]. Viel höhere Anzahlen werden nur von Wirbeltieren angegeben. Für den Modellorganismus Homo sapiens werden aktuell 411 genannt, davon allein 145 verschiedene Typen von Neuronen (Nervenzellen)[32]. Der Vergleich der verschiedenen Zelltypen ist heute mittels „molekularem Fingerabdruck“ auch zwischen Tieren möglich, die verschiedenen Stämmen angehören; hier war früher unklar, ob ähnliche Zelltypen auf gemeinsame Vorfahren zurückgehen, oder ob sie durch konvergente Evolution sekundär zueinander ähnlicher geworden waren. Dabei zeigte sich als genereller Trend, dass mehrfach spezialisierte Zellen in einfachen Vielzellern sich zu immer höher spezialisierten in komplexen Vielzellern entwickelt haben müssen. Beispielsweise besitzen Nesseltiere Zellen, die dem äußeren Deckgewebe (Epithel) angehören, die sowohl Sinnesreize aus der Umwelt aufnehmen, als auch fähig sind, sich wie Muskelzellen zusammenzuziehen (kontrahieren). Diese Funktionen sind in höheren Vielzellern (in dazu homologen Zellen) auf verschiedene Zelltypen aufgeteilt.
Die Differenzierung ist also nicht vorangeschritten, indem die ersten Vielzeller nach und nach neue Funktionen erworben und sich dazu neue Zelltypen (und Gewebe bzw. Organe) zugelegt hätten. Vielmehr besaßen die ursprünglichen Zellen bereits die meisten der späteren Funktionen, vereint in einer einzigen Zelle. Diese „Alleskönner“ haben sich dann arbeitsteilig differenziert. Die wenigen Zelltypen der einfach strukturierten Vielzeller – und noch mehr der Einzeller – sind also nicht einfacher als diejenigen der komplexeren Vielzeller, sondern im Gegenteil komplexer.[29][33]
Modellorganismen
Die Gattung Volvox
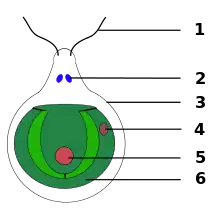 Bau der Chlamydomonas
Bau der Chlamydomonas
1. Geißeln
2. Vakuole
3. Zellwand
4. Augenfleck
5. Zellkern
6. becherförmiger Chloroplast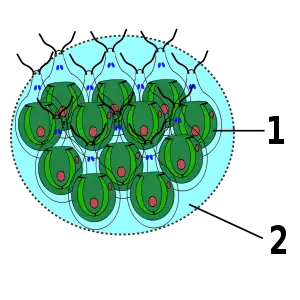 Bau der Grünalge Gonium
Bau der Grünalge Gonium
1. chlamydomonas-
ähnliche Zelle
2. Gallerte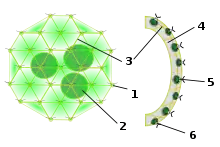 Bau der Volvox
Bau der Volvox
1. chlamydomonas-
ähnliche Zelle
2. Tochterkugel
3. Plasmabrücken
4. Gallerte
5. Fortpflanzungszelle
6. Körperzelle
Die Ordnung Volvocales wird vielfach als Modell zur Erforschung der ersten Stadien der Mehrzelligkeit genutzt, weil sie die komplette Serie von echten Einzellern, wenigzelligen Zellkolonien bis hin zu echten Vielzellern enthält, deren Zellen zudem gut vergleichbare Gestalt und Morphologie aufweisen. Die Volvocales sind Grünalgen (Chlorophyta), deren Entwicklungslinie sich bereits vor mehr als einer Milliarde Jahren von derjenigen getrennt hat, die zu den vielzelligen Landpflanzen (Embryophyta) führte. Man nimmt an, dass der (vollkommen unabhängige) Übergang zur Mehrzelligkeit hier später (vermutlich in der Trias) stattfand[34].
Als Vertreter der einzelligen Volvocales mit Abstand am besten erforscht ist die Art Chlamydomonas reinhardtii. Es handelt sich um eine bodenlebende Alge, die vermutlich nur im östlichen Nordamerika vorkommt[35], heute aber weltweit in Laboren kultiviert wird. Verwandte Arten sind überall auf dem Globus verbreitet. Bodenlebende Chlamydomonas-Arten sind extrem hart gegenüber widrigen Umweltbedingungen und kaum umzubringen. Sie leben in angefeuchtetem Schlamm oder kleinen Wasseransammlungen der Bodenoberfläche. Sind die Bedingungen günstig, teilen sich die (haploiden) Zellen asexuell. Hierbei werden in schneller Folge innerhalb der Zellwand der Mutterzelle zwei mitotische Teilungen durchgeführt; die vier Tochterzellen trennen sich anschließend und leben als Einzeller weiter.
Werden die Bedingungen ungünstig, wandeln sich die Zellen zu Gameten (gleich groß, deshalb nicht Männchen und Weibchen, sondern plus- und minus-Form genannt). Nach der Paarung bilden sie extrem widerstandsfähige Dauersporen (sogenannte Zygosporen), die in ausgetrockneten Algenkrusten auf bessere Bedingungen warten. So kommen sie sogar in Wüstenböden vor. Durch die stark wechselnden Umweltbedingungen im Boden müssen die Zellen unterschiedlichste Umweltbedingungen tolerieren können. So können sie auch unter sauerstofffreien (anaeroben) Bedingungen weiterleben. Erhalten sie kein Licht, schalten sie auf heterotrophe Ernährung (mit Essigsäure als Basis) um. Fehlende Nährstoffe wie Phosphor und Stickstoff können sie mit speziellen Enzymen anreichern. Ihre Widerstandsfähigkeit gegenüber Schwermetallen ist so hoch, dass über ihren Einsatz zur biotechnologischen Reinigung schwermetallbelasteter Abwässer nachgedacht wird.[35] Chlamydomonas-Zellen sind durch zwei Geißeln beweglich; sie schwimmen zum Licht hin (Phototaxis), dessen Richtung sie durch einen Augenfleck erkennen können.
Da Chlamydomonas-Zellen sich mehrmals in schneller Folge teilen, nachdem sie erheblich an Größe zugenommen haben, erscheint der Übergang zum Stadium der Zellkolonie sehr naheliegend. Hierzu ist es lediglich erforderlich, dass die Tochterzellen nach der Teilung aneinander haften bleiben. Innerhalb der Volvocales existieren eine Reihe von Gattungen, die solchen Chlamydomonas-Kolonien ähneln. Die Zellenzahl ist (je nach Teilungsschritten) 4, 8, 16 oder ein Vielfaches davon. Scheibenförmige Zellkolonien aus solchen Zellen werden z. B. in die Gattungen Gonium und Eudorina gestellt.
Ab einer gewissen Größe der Zellkolonie ist diese einfache Organisation nicht mehr ausreichend. Alle größeren Vertreter bilden hohlkugelige Formen aus. Diese werden in die Gattung Volvox gestellt. Tatsächlich ist dieser Übergang allerdings mehrfach unabhängig voneinander erfolgt. Die Arten der „Gattung“ sind also nicht näher miteinander verwandt, sondern gehören verschiedenen Entwicklungslinien an, die konvergent dieselbe Form entwickelt haben. In allen Fällen wurde bei der Größenzunahme die auftretenden Probleme auf ähnlich Art gelöst.
Volvox-Organismen bestehen aus zwei Zelltypen. Neben die Chlamydomonas-ähnlichen somatischen Zellen sind hier Keimzellen getreten, die ausschließlich der (asexuellen) Fortpflanzung dienen (daneben existiert weiterhin die sexuelle Vermehrung unter Bildung von Dauersporen). Für diese Differenzierung könnte direkt die Größenzunahme verantwortlich sein[36]. Aufgrund der Zellorganisation (die Centriolen, die den Spindelapparat bei der Zellteilung organisieren, dienen gleichzeitig als Ausgangspunkt der Geißeln) können die Zellen nicht mehr lange schwimmen, nachdem sie angefangen haben, sich zu teilen. Teilen sich zu viele Zellen innerhalb einer Volvox-Kugel gleichzeitig, sinkt sie zu Boden und geht zugrunde (die Kugeln sind schwerer als Wasser und müssen dauerschwimmen). Bei einigen Volvox-Arten wie z. B. Volvox carteri sind die generativen Zellen durch asymmetrische Teilung zudem größer und können größere Embryonen liefern, die so einen Startvorteil besitzen. Die Embryonen werden bei Volvox nicht nach außen, sondern ins Innere der Hohlkugel abgegeben. Dies liegt daran, dass sie zunächst nicht lebensfähig wären, da ihre Geißeln nach innen zeigen. Sie müssen sich zunächst in einem Inversion genannten Vorgang umstülpen. Die fertigen Embryonen enthalten alle Zellen der ausgewachsenen Kugel. Sie sind zunächst noch durch Zytoplasmabrücken miteinander verbunden die aber (bei den meisten Volvox-Arten) später abgeschnürt werden.
Die Bildung des vielzelligen Organismus Volvox setzt also trotz seiner Einfachheit bereits eine recht komplexe Abfolge von Schritten voraus[37]. Die Zelldifferenzierung muss gesteuert, die extrazelluläre Matrix (die sich aus der Zellwand von Chlamydomonas entwickelt hat), die 99 Prozent des Kugelvolumens einnimmt, muss koordiniert abgeschieden werden, der Embryo muss die komplizierte Inversion durchmachen ... Dies setzt erhebliche Vorteile für diese Entwicklung voraus, die einen entsprechenden Selektionsdruck aufgebaut haben. Worin diese Vorteile bestehen, ist nicht völlig klar. Am häufigsten genannt werden die Einlagerung von Nährstoffen (v. a. Phosphor) in die extrazelluläre Matrix als Speicher für Mangelzeiten, und der bessere Schutz, den die Größe gegenüber vielen Fressfeinden (z. B. Filtrierern) verleiht.
Während Chlamydomonas fast überall verbreitet ist, findet sich Volvox dem gegenüber nur in relativ wenigen Lebensräumen, vor allem Tümpeln und sehr nährstoffreichen (geschichteten) Seen, wo sie häufiger werden kann als Chlamydomonas. Möglicherweise kommt ihr in diesen meist trüben Gewässern auch ihre höhere Beweglichkeit durch zahlreiche koordiniert schlagende Geißeln zugute[38]. Volvox besitzt also seine Vorteile gegenüber Chlamydomonas vor allem in einem Lebensraum, der besonders günstige Entwicklungsmöglichkeiten bietet. Die Vorteile sind vor allem unter ungünstigen Umweltbedingungen keineswegs unzweideutig: Durch den molekularen Stammbaum der Volvocales ist es heute klar, dass es in der Evolution der Gruppe zu zahlreichen Reversionen, d. h. Rückentwicklungen zu wenigerzelligen Formen, gekommen sein muss[39]. Bietet die Arbeitsteilung der Zellen zu wenige Vorteile, können vor allem bei weniger großen Zellkolonien die somatischen Zellen (die ja ansonsten altustisch auf eigene Fortpflanzung verzichten) wieder zu unabhängiger Vermehrung übergehen.
Soziale Amöben
Die Eumycetozoa sind eine Organismengruppe, die lange als Pilze („Schleimpilze“) bezeichnet worden sind, mit denen sie aber nichts außer einer oberflächlichen Ähnlichkeit der Fruchtkörper tatsächlich gemeinsam haben. Heute ist ihre Zugehörigkeit zu den Amoebozoa ohne Zweifel erwiesen. Am besten erforscht ist die Gruppe der Dictyostelia mit dem Modellorganismus Dictyostelium discoideum. Dictyostelia umfassen etwa 100 Arten. Sie kommen weltweit in Böden aller Art vor, besitzen aber einen Verbreitungsschwerpunkt in Waldböden[40]. Die Art Dictyostelium discoideum ist beschränkt auf die chinesische Küstenregion, Japan und das östliche Nordamerika[41]. Molekulare Untersuchungen haben erwiesen, dass die drei nach der Gestalt der Fruchtkörper unterschiedenen konventionellen Gattungen der Dictyostelia keine natürlichen Verwandtschaftsgruppen sind, die (insgesamt monophyletische) Gruppe kann in vier Entwicklungslinien gegliedert werden, die jeweils Angehörige mehrerer Gattungen umfassen.[42] Eine Revision ist aber unterblieben, vor allem auch deshalb, um die eingeführten Artnamen nicht verändern zu müssen.
Dictyostelia ernähren sich als einzellige, schwarmbildende Amöben von Bodenbakterien, die sie durch Phagozytose verschlingen. In dieser Lebensphase vermehren sie sich asexuell durch einfache Zellteilung. Die Bakterien werden durch ihre Stoffwechselprodukte, vor allem Folsäure, erkannt. Die Amöben sind durch Ausstülpen von Pseudopodien beweglich, die (u. a.) durch ein Zellskelett aus Aktin und Myosin-Fasern gebildet werden. Diese lockeren Schwärme aus Einzellern können einen vielzelligen Fruchtkörper ausbilden, und zwar dann, wenn ihre Nahrung beginnt, knapp zu werden. Zunächst schließen sich die Amöben zu einem aggregierten, beweglichen Gebilde zusammen, das „slug“ (englisch für Nacktschnecke) oder auch Pseudoplasmodium genannt wird und eine Weile umherkriecht. Wird eine dafür günstige Stelle erreicht, wandelt sich dieser in einen Sporokarp genannten Fruchtkörper um. Der Fruchtkörper besteht aus einem vielzelligen Stiel, der oben je nach Art einen oder mehrere kugelige Sporenbehälter trägt. Obwohl man bis zu fünf Zelltypen unterschieden hat, besteht er prinzipiell aus zwei unterschiedlichen Zelllinien. Die Sporenzellen bilden letztlich neue Amöben aus; die Stielzellen gehen mit dem Fruchtkörper zugrunde. Die Bildung des vielzelligen Fruchtkörpers aus bis zu etwa 100.000 einzelligen, unabhängigen Amöben setzt intensive Kommunikation zwischen den Einzelzellen voraus, die bei Dictyostelium ausgiebig erforscht worden ist. Außerdem sind auch hier altruistische Zellen beteiligt: Die Amöben, die die Stielzellen ausbilden, opfern ihre eigene Fortpflanzungsmöglichkeit zugunsten ihrer Verwandten. Verhaltenskoordination und Differenzierung beruhen bei Dictyostelium auf chemischer Kommunikation. Jede Zelle gibt Signalstoffe ab, die von Artgenossen wahrgenommen werden und orientiertes Verhalten (Chemotaxis) und Zelldifferenzierung auslösen.
In Dictyostelium discoideum und verwandten Arten (nicht aber in anderen Dictyostelia) beruht die Kommunikation zwischen den Zellen zu großen Teilen auf G-Protein Rezeptoren mit den Signalmolekülen cAMP und cGMP. Sie entspricht damit der Kommunikation zwischen vielen Zellen der mehrzelligen Tiere, z. B. den Leukozyten des Bluts der Säugetiere[43]. Die Amöben messen kontinuierlich sowohl die Bakterienkonzentration in ihrer Umgebung (wohl über den Folsäuregehalt) als auch die Zelldichte der sie umgebenden Amöben (über ein Glycoprotein). Bei Nahrungsmangel beginnen zunächst wenige Schrittmacher-Zellen, cAMP abzugeben. Dies veranlasst die Amöben, sich zu einem dichten Aggregat zusammenzuschließen, indem sie sich dem Stoffgradienten folgend zum Ort der höchsten Konzentration vorwärtsbewegen. Die Zellmasse scheidet nach außen eine umhüllende Zellulose-haltige Schleimschicht ab. Die Zellmasse streckt sich schließlich in die Länge und beginnt als „slug“ umherzukriechen, wobei sie neben chemischen auch optische und Temperatur-Reize beeinflussen. Die Zellen des Vorderendes des „slugs“ differenzieren letztlich zum Stiel und sterben ab. Die anderen Zellen (etwa vier Fünftel der Gesamtzahl) bilden einen kugeligen Sporenkörper aus, der als Ausbreitungs- und Dauerstadium dient. Die Zelldifferenzierung wird über weitere Signalmoleküle gesteuert, die als DIF (differentiation-inducing factor) bezeichnet werden[44].
Obwohl Dictyostelium-Zellen in der Nahrungsphase oft ausgedehnte Aggregate aus klonalen Einzelzellen bilden, kommt es gelegentlich zur Ausbildung gemischter („chimärischer“) Fruchtkörper[44]. Die Zellen sind aber imstande Verwandte zu erkennen, mit denen sie sich bevorzugt zusammenschließen. Dennoch müssen sie sich, wie alle altruistischen Kollektive, mit „Betrügern“ herumschlagen; dies sind in diesem Falle Zelllinien, die ausschließlich Sporen bilden und nichts zur Stielbildung beitragen. Solche betrügerischen Stämme können in natürlichen Populationen eingestreut sein. Zumindest einige Stämme haben das Vermögen entwickelt, sie zu erkennen und auszuschließen.
Vielzellige Tiere
Die vielzelligen Tiere oder Metazoa bilden (nach molekularen Stammbaumanalysen) eine monophyletische Abstammungsgemeinschaft, das heißt, sie stammen alle von einer gemeinsamen Stammform ab. Diesen sogenannten „Urmetazoen“[45] versucht die Forschung vor allem durch Vergleich der Baupläne und Entwicklung der einfachsten heute noch lebenden Metazoa zu klären. Wichtigste Kandidaten für die ursprünglichsten noch lebenden Metazoa sind die Schwämme (Phylum Porifera).
Seit der Entdeckung der einzelligen bzw. koloniebildenden Kragengeißeltierchen (Choanoflagellaten) fiel deren außergewöhnliche Ähnlichkeit zu den Kragengeißelzellen (Choanozyten) der Schwämme auf. Beide bestehen aus einem Zellkörper, der an einem Ende eine einzelne Geißel trägt. Diese ist umgeben von einem „Kragen“ aus Zellfortsätzen (Mikrovilli). Die Ernährung erfolgt, indem Nahrungspartikel von der Geißel an den Kragen gestrudelt werden, wo sie kleben bleiben und mittels Phagozytose aufgenommen werden. Schon im 19. Jahrhundert wurde deshalb vermutet, dass sich Schwämme, und damit alle Metazoa, aus Kolonien von Kragengeißeltierchen entwickelt haben könnten. Dieses Modell gilt bis heute als wichtigste Hypothese über den Ursprung der Metazoa[46]. Die mobileren „höheren“ Metazoa wie die Bilateria könnten sich danach über ein dem Larvenstadium der Schwämme, der Planula, entsprechendes Stadium entwickelt haben, während das festsitzende, filtrierende Stadium aufgegeben wurde (Neotenie).
Genauere Untersuchung der Choanoflagellaten, zum Beispiel der Art Salpingoeca rosetta, ergaben bereits bei diesen eine bis dahin unerwartete Vielfalt an Zelltypen und Lebensformen[47]. Salpingoeca kommt in fünf unterschiedlichen Stadien vor (die vorher teilweise als unterschiedliche Arten oder sogar Gattungen aufgefasst wurden): a) Festsitzende (sessile) Einzelzellen, die in einer becherförmigen, gestielten Hülle oder „Theca“ sitzen, b) langsam schwimmende Einzelzellen, c) schnell schwimmende Einzelzellen ohne „Kragen“, dadurch Spermien sehr ähnlich, d) kugelförmige („rosettenförmige“) und e) kettenförmige, frei schwimmende Zellkolonien. Dabei sind fünf verschieden differenzierte Zelltypen unterscheidbar. Dies sind nicht weniger als in vielen Schwämmen. Der wesentliche Unterschied ist hier, dass sie nicht gleichzeitig in einem organisierten Mehrzeller auftreten, sondern zeitlich nacheinander. Der Übergang zwischen den Formen wird durch Umweltreize ausgelöst, beispielsweise löst ein Molekül, das in als Nahrung dienenden Bakterienarten vorkommt, die Bildung der rosettenförmigen Kolonien aus[48].
Für den Übergang von einer hypothetischen Ahnform, die einer Kolonie der heutigen Kragengeißeltierchen ähnelt[49], zu einem Vielzeller wurden verschiedene Modelle vorgeschlagen:
- „Gastraea“: Demnach hätte sich zunächst eine einfache, hohlkugelige Zellkolonie (oder „Blastaea“) gebildet. In einem zweiten Schritt habe sich diese eingestülpt, wodurch eine zweilagige kugelförmige Kolonie entstanden sei. Diese hätte sich anschließend differenziert. Diese Hypothese stammt noch aus dem 19. Jahrhundert, sie geht auf den Biologen Ernst Haeckel zurück, der sie in Analogie zum Blastula und Gastrula-Stadium der Embryogenese entwickelte. Eine moderne Fassung stammt z. B. von Claus Nielsen[46]
- „Placula“: Dieser Hypothese nach wären die Vielzeller aus einer bodenlebenden Kolonie hervorgegangen, deren Zellen in einen unteren, beweglichen und einen oberen, der Nahrungsaufnahme dienenden Teil differenziert wären. Diese hätten sich später zu zwei Zelllagen differenziert. Diese zuerst von dem Zoologen Otto Bütschli formulierte Hypothese gewinnt Glaubwürdigkeit durch die Entdeckung der Placozoa, die diesem Stadium ähneln[50].
- „Synzoospore“: Nach dieser Hypothese wären die ersten beweglichen Stadien (die möglicherweise der Blastaea ähneln würden), keine frei lebenden Organismen gewesen, sondern nur ein bewegliches Larvenstadium einer differenzierten festsitzenden (sessilen) Zellkolonie oder eines Aggregats von Einzellern. Dieses wäre dadurch entstanden, dass, zunächst einzellige Schwärmer (Zoosporen) als Verband aneinander haften blieben. Die Theorie wurde von dem russischen Biologen Alexej Alexejewitsch Zachvatkin aufgestellt.[51]
Vielzellige Pflanzen
Die Mikrofossilien von Arctacellularia tetragonala gelten seit Januar 2022 als die ersten eindeutig photosynthetisch aktiven mehrzelligen Organismen. Sie wurden gefunden im Kongobecken, Demokratische Republik Kongo, ihr Alter ist etwa 1 Milliarde Jahr (Proterozoikum alias 3. Präkambrium, vor 2.500–514 Millionen Jahren).[52] Es handelt sich um undifferenzierte Zellfäden, vermutlich mit siphonocladaler Organisationsstufe (durch Septen gekammerte verzweigte, mehrkernige fädige Thalli). In den Fossilien wurden Tetrapyrrole nachgewiesen, vermutlich aus Chlorophyllen. Arctacellularia ist, soweit rekonstruierbar, ein Vertreter einer nicht näher bestimmbaren Entwicklungslinie der eukaryotischen Algen.[53]
Siehe auch
Einzelnachweise
- Sina M. Adl, Alastair G. B. Simpson, Mark A. Farmer, Robert A. Andersen, O. Roger Anderson, John A. Barta, Samual S. Bowser, Guy Bragerolle, Robert A. Fensome, Suzanne Fredericq, Timothy Y. James, Sergei Karpov, Paul Kugrens, John Krug, Christopher E. Lane, Louise A. Lewis, Jean Lodge, Denis H. Lynn, David G. Mann, Richard M. McCourt, Leonel Mendoza, Øjvind Moestrup, Sharon E. Mozley-Standridge, Thomas A. Nerad, Carol A. Shearer, Alexey V. Smirnov, Frederick W. Spiegel, Max F. J. R. Taylor (2005): The New Higher Level Classification of Eukaryotes with Emphasis on the Taxonomy of Protists. Journal of Eukaryotic Microbiology 52 (5): 399–451. doi:10.1111/j.1550-7408.2005.00053.x
-
- S. M. Adl, B. S. Leander, A. G. Simpson, J. M. Archibald, O. R. Anderson, D. Bass, S. S. Bowser, G. Brugerolle, M. A. Farmer, S. Karpov, M. Kolisko, C. E. Lane, D. J. Lodge, D. G. Mann, R. Meisterfeld, L. Mendoza, O. Moestrup, S. E. Mozley-Standridge, A. V. Smirnov, F. Spiegel (2007): Diversity, Nomenclature, and Taxonomy of Protists. Systematic Biology 56(4): 684–689. doi:10.1080/10635150701494127
- Adl, S. M., Simpson, A. G. B., Lane, C. E., Lukeš, J., Bass, D., Bowser, S. S., Brown, M. W., Burki, F., Dunthorn, M., Hampl, V., Heiss, A., Hoppenrath, M., Lara, E., le Gall, L., Lynn, D. H., McManus, H., Mitchell, E. A. D., Mozley-Stanridge, S. E., Parfrey, L. W., Pawlowski, J., Rueckert, S., Shadwick, L., Schoch, C. L., Smirnov, A. and Spiegel, F. W. (2012), The Revised Classification of Eukaryotes. Journal of Eukaryotic Microbiology, 59: 429–514. doi:10.1111/j.1550-7408.2012.00644.x
- Andrew H. Knoll (2011): The Multiple Origins of Complex Multicellularity. Annual Review of Earth and Planetary Sciences 39: 217–239. doi:10.1146/annurev.earth.031208.100209
- Sean B. Carroll (2001): Chance and necessity: the evolution of morphological complexity and diversity. Nature 409: 1102–1109.
- William C. Ratcliff, R. Ford Denison, Mark Borrello, Michael Travisano (2012): Experimental evolution of multicellularity. Proceedings of the National Academy of Sciences USA Vol. 109 No.5: 1595–1600. doi:10.1073/pnas.1115323109
- Lewis Wolpert & Eörs Szathmáry (2002): Evolution and the egg. Nature 420: 745.
- Dale Kaiser (2001): Building a multicellular organism. Annual Revue of Genetics 35: 103–123.
- >Richard K. Grosberg & Richard R. Strathmann (2007): The Evolution of Multicellularity: A Minor Major Transition? Annual Review of Ecology, Evolution, and Systematics 38: 621–654. doi:10.1146/annurev.ecolsys.36.102403.114735
- David L. Kirk (2005): A twelve-step program for evolving multicellularity and a division of labor. BioEssays 27: 299–310.
- Richard E. Michod (2007): Evolution of individuality during the transition from unicellular to multicellular life. Proceedings of the National Academy of Sciences USA vol. 104, suppl. 1: 8613–8618. doi:10.1073/pnas.0701489104
- C. Athena Aktipis, Amy M. Boddy, Gunther Jansen, Urszula Hibner, Michael E. Hochberg, Carlo C. Maley, Gerald S. Wilkinson (2015): Cancer across the tree of life: cooperation and cheating in multicellularity. Philosophical Transactions of the Royal Society B 370: 20140219. doi:10.1098/rstb.2014.0219
- Raymond E. Goldstein (2009): Evolution of Biological Complexity. Seminaire Poincare XII: 75–88.
- J.C. Ameisen (2002): On the origin, evolution, and nature of programmed cell death: a timeline of four billion years. Cell Death and Differentiation 9: 367–393.
- Marıa Segovia, Liti Haramaty, John A. Berges, Paul G. Falkowski (2003): Cell Death in the Unicellular Chlorophyte Dunaliella tertiolecta. A Hypothesis on the Evolution of Apoptosis in Higher Plants and Metazoans. Plant Physiology Vol. 132: 99–105.
- Daniel J. Franklin, Corina P.D. Brussaard, John A. Berges (2006): What is the role and nature of programmed cell death in phytoplankton ecology? European Journal of Phycology 41(1): 1–14. doi:10.1080/09670260500505433
- Hanna Engelberg-Kulka, Shahar Amitai, Ilana Kolodkin-Gal, Ronen Hazan (2006): Bacterial Programmed Cell Death and Multicellular Behavior in Bacteria. PLoS Genetics Volume 2, Issue 10, e135. doi:10.1371/journal.pgen.0020135
- Kris Vleminckx (2001): Adhesive Specificity and the Evolution of Multicellularity. Encyclopedia of Life Sciences doi:10.1038/npg.els.0001273
- Monica Medina, Allen G. Collins, John W. Taylor, James W. Valentine, Jere H. Lipps, Linda Amaral-Zettler, Mitchell L. Sogin (2003): Phylogeny of Opisthokonta and the evolution of multicellularity and complexity in Fungi and Metazoa. International Journal of Astrobiology 2(3): 203–211. doi:10.1017/S1473550403001551
- Nicole King, M. Jody Westbrook, Susan L. Young, Alan Kuo, Monika Abedin, Jarrod Chapman, Stephen Fairclough, Uffe Hellsten, Yoh Isogai, Ivica Letunic, Michael Marr, David Pincus, Nicholas Putnam, Antonis Rokas, Kevin J. Wright, Richard Zuzow, William Dirks, Matthew Good, David Goodstein, Derek Lemons, Wanqing Li, Jessica B. Lyons, Andrea Morris, Scott Nichols, Daniel J. Richter, Asaf Salamov, JGI Sequencing, Peer Bork, Wendell A. Lim, Gerard Manning, W. Todd Miller, William McGinnis, Harris Shapiro, Robert Tjian, Igor V. Grigoriev, Daniel Rokhsar (2008): The genome of the choanoflagellate Monosiga brevicollis and the origin of metazoans. Nature 451: 783–788 doi:10.1038/nature06617
- Gradimir N. Misevic, Camille Ripoll, Jonathan Norris, Vic Norris, Yann Guerardel, Emmanuel Maes, Gerard Strecker, Pascal Ballet, Yannis Karamanos, Lazar T. Sumanovski, Octavian Popescu, Nikola Misevic (2007): Evolution of multicellularity in Porifera via self-assembly of glyconectin carbohydrates. in: M.R: Custódio,G. Lôbo-Hajdu, E. Hajdu, G. Muricy (editors): Porifera research: biodiversity, innovation and sustainability. Série Livros 28, Museu Nacional, Rio de Janeiro. PDF (Memento des Originals vom 29. Oktober 2013 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.
- Noriko Ueki, Shigeru Matsunaga, Isao Inouye, Armin Hallmann (2010): How 5000 independent rowers coordinate their strokes in order to row into the sunlight: Phototaxis in the multicellular green alga Volvox. BMC Biology 8: 103 download
- Simon E. Prochnik, James Umen, Aurora M. Nedelcu, Armin Hallmann, Stephen M. Miller, Ichiro Nishii, Patrick Ferris, Alan Kuo, Therese Mitros, Lillian K. Fritz-Laylin, Uffe Hellsten, Jarrod Chapman, Oleg Simakov, Stefan A. Rensing, Astrid Terry, Jasmyn Pangilinan, Vladimir Kapitonov, Jerzy Jurka, Asaf Salamov, Harris Shapiro, Jeremy Schmutz, Jane Grimwood, Erika Lindquist, Susan Lucas, Igor V. Grigoriev, Rüdiger Schmitt, David Kirk, Daniel S. Rokhsar (2010): Genomic Analysis of Organismal Complexity in the Multicellular Green Alga Volvox carteri. Science. 329(5988): 223–226. doi:10.1126/science.1188800
- Gerard Manning, Susan L. Young, W. Todd Miller, Yufeng Zhai The protist, Monosiga brevicollis, has a tyrosine kinase signaling network more elaborate and diverse than found in any known metazoan. Proceedings of the National Academy of Sciences USA 105 (28): 9674–9679.
- Annalisa M. VanHook (2008): Facilitating Multicellularity. Science Signaling Vol. 1, Issue 29: p. ec262 doi:10.1126/scisignal.129ec262
- Nicole King, Christopher T. Hittinger, Sean B. Carroll (2003): Evolution of Key Cell Signaling and Adhesion Protein Families Predates Animal Origins. Science 301: 361–363.
- Übersicht in Stuart A.West, Stephen P. Diggle, Angus Buckling, Andy Gardner, Ashleigh S. Griffin (2007): The Social Lives of Microbes. Annual Review of Ecology, Evolution, and Systematics 38: 53–77. doi:10.1146/annurev.ecolsys.38.091206.095740
- Jan Mazek & Anne O. Summers (2008): General Characteristics of Procaryotic Genomes. In: Ying Xu & J Peter Gogarten (editors): Computational Methods for Understanding Bacterial and Archaeal Genomes. Series on Advances in Bioinformatics and Computational Biology: Volume 7. ISBN 978-1-86094-982-1
- Detlev Arendt (2008): The evolution of cell types in animals: emerging principles from molecular studies. Nature Reviews Genetics 9: 868–882.
- Bernd Schierwater, Danielle de Jong, Rob DeSalle (2009): Placozoa and the evolution of Metazoa and intrasomatic cell differentiation. International Journal of Biochemistry & Cell Biology Volume 41, Issue 2: 370–379. doi:10.1016/j.biocel.2008.09.023
- Graham Bell & Anne O. Moors (1997): Size and complexity among multicellular organisms. Biological Journal of the Linnean Society 60: 345–363.
- M.K. Vickaryous & B.K: Hall (2006): Human cell type diversity, evolution, development, and classification with special reference to cells derived from the neural crest. Biological Reviews 81: 425–455. doi:10.1017/S1464793106007068
- Daniel W. McShea (2002): A complexity drain on cells in the evolution of multicellularity. Evolution 56(3): 441–452.
- Matthew D. Herron, Jeremiah D. Hackett, Frank O. Aylward, Richard E. Michod (2009): Triassic origin and early radiation of multicellular volvocine algae. Proceedings of the National Academy of Sciences USA Vol. 106 No.9: 3254–3258. doi:10.1073/pnas.0811205106
- Elisabeth H. Harris (2001): Chlamydomonas as model organism. Annual Review of Plant Physiology and Plant Molecular Biology 52: 363-406.
- Cristian A. Solari, Aurora M. Nedelcu, Richard E. Michod (2003): Fitness, Life-history, and the Evolution of Complexity in Volvocalean Green Algae. PDF
- David L. Kirk (2005): A twelve-step program for evolving multicellularity and a division of labor. BioEssays 27.3: 299–310.
- Cristian A. Solari, Richard E. Michod, Raymond E. Goldstein (2008): Volvox barberi, the fastest swimmer of the Volvocales (Chlorophyceae). Journal of Phycology 44: 1395-1398. doi:10.1111/j.1529-8817.2008.00603.x
- Joel L. Sachs (2008): Resolving the first steps to multicellularity. Trends in Ecology and Evolution Vol.23 No.5: 245–248. doi:10.1016/j.tree.2008.02.003
- Steven L. Stephenson & Alan Feest (2012): Ecology of Soil Eumycetozoans. Acta Protozoologica 51 (3): 201–208. doi:10.4467/16890027AP.12.016.0762
- A.R. Swanson, E.M. Vadell, J.C. Cavender (1999): Global distribution of forest soil dictyostelids. Journal of Biogeography 26: 133–148. doi:10.1046/j.1365-2699.1999.00250.x
- Pauline Schaap, Thomas Winckler, Michaela Nelson, Elisa Alvarez-Curto, Barrie Elgie, Hiromitsu Hagiwara, James Cavender, Alicia Milano-Curto, Daniel E. Rozen, Theodor Dingermann, Rupert Mutzel, Sandra L. Baldauf (2006): Molecular Phylogeny and Evolution of Morphology in the Social Amoebas. Science Vol. 314 no. 5799: 661–663. doi:10.1126/science.1130670
- Carole A. Parent & Peter N. Devreotes A Cell's Sense of Direction. Science Vol. 284 no. 5415: 765–770. doi:10.1126/science.284.5415.765
- Si. I. Li & Michael D. Purugganan (2011): The cooperative amoeba: Dictyostelium as a model for social evolution. Trends in Genetics Vol. 27, No. 2: 48–54. doi:10.1016/j.tig.2010.11.003
- Werner E.G. Müller (2001): How was metazoan threshold crossed? The hypothetical Urmetazoa. Comparative Biochemistry and Physiology Part A 129: 433–460.
- Claus Nielsen (2008): Six major steps in animal evolution: are we derived sponge larvae? Evolution & Development 10(2): 241–257.
- Mark J. Dayel, Rosanna A. Alegado, Stephen R. Fairclough, Tera C. Levin, Scott A. Nichols, Kent McDonald, Nicole King (2011): Cell differentiation and morphogenesis in the colony-forming choanoflagellate Salpingoeca rosetta. Developmental Biology 357(1): 73–82. doi:10.1016/j.ydbio.2011.06.003
- Rosanna A Alegado, Laura W Brown, Shugeng Cao, Renee K Dermenjian, Richard Zuzow, Stephen R Fairclough, Jon Clardy, Nicole King (2012): A bacterial sulfonolipid triggers multicellular development in the closest living relatives of animals. eLife 2012;1:e00013 doi:10.7554/eLife.00013
- aber nicht identisch damit ist. vgl. M. Carr, B.S.C. Leadbeater, R. Hassan, M. Nelson, S.L. Baldauf (2008): Molecular phylogeny of choanoflagellates, the sister group to Metazoa. Proceedings of the National Academy of Sciences vol. 105 no. 43: 16641–16646 doi:10.1073/pnas.0801667105
- Bernd Schierwater, Michael Eitel, Wolfgang Jakob, Hans-Jürgen Osigus, Heike Hadrys, Stephen L. Dellaporta, Sergios-Orestis Kolokotronis, Rob DeSalle (2009): Concatenated Analysis Sheds Light on Early Metazoan Evolution and Fuels a Modern ‘‘Urmetazoon’’ Hypothesis. PLoS Biology 7(1): e1000020. doi:10.1371/journal.pbio.1000020
- Kirill V. Mikhailov, Anastasiya V. Konstantinova, Mikhail A. Nikitin, Peter V. Troshin, Leonid Yu. Rusin, Vassily A. Lyubetsky, Yuri V. Panchin, Alexander P. Mylnikov, Leonid L. Moroz, Sudhir Kumar, Vladimir V. Aleoshin (2009): The origin of Metazoa: a transition from temporal to spatial cell differentiation. BioEssays 31: 758–768. doi:10.1002/bies.200800214
- Marie Catherine Sforna, Corentin C. Loron, C. F. Demoulin, C. François, Y. Cornet, Y. J. Lara, D. Grolimund, D. F. Sanchez, K. Medjoubi, A. Somogyi, A. Addad, A. Fadel, P. Compère, D. Baudet, J. J. Brocks, Emmanuelle J. Javaux: Intracellular bound chlorophyll residues identify 1 Gyr-old fossils as eukaryotic algae. In: Nature Communications. 13, Nr. 1, 2022, S. Article number 146. doi:10.1038/s41467-021-27810-7. Dazu:
- Josephine Franke: Eukaryotische Algen schon vor einer Milliarde Jahren – Chlorophyll-Nachweis in Mikrofossil identifiziert eine der ältesten echten Algen. Auf scinexx.de vom 17. Januar 2022
- Identification of one of the first multicellular algae thanks to its chlorophyll fossilized for 1 billion years. EurekAlert! vom 11. Januar 2022. (englisch)
- M.C. Sforna, C.C. Loron, C.F. Demoulin et al. (2022): Intracellular bound chlorophyll residues identify 1 Gyr-old fossils as eukaryotic algae. Nature Communications 13: 146 doi:10.1038/s41467-021-27810-7