GPI-Anker
Glycosylphosphatidylinositol-Anker, kurz GPI-Anker, engl. GPI anchor, kommen in allen eukaryotischen Zellen vor. Ihre Hauptaufgabe ist es, Glycoproteine der Zelloberfläche an der Außenseite der Plasmamembran fest zu verankern. Der GPI-Anker wird im Lumen des Endoplasmatischen Retikulums an die terminale Carboxygruppe des Glycoproteins angehängt, wobei die Signalsequenz, welche für den Import ins endoplasmatische Retikulum codierte, abgeschnitten wird. Da der GPI-Anker nur mit einer Monolipidschicht der Biomembran wechselwirkt, wird eine Interaktion auf der anderen Seite der Doppelmembran verhindert und leistet einen Beitrag zur asymmetrischen Proteinzusammensetzung der Doppelmembran.
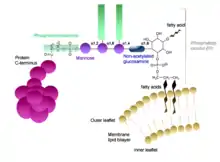
GPI-Anker führen ebenfalls zur erhöhten Beweglichkeit einiger Proteine auf der Membran und unterstützen die Signalübertragung sowie den zellulären Transport. Zusätzlich spielen sie eine wichtige Rolle bei der Bildung von Antigenen auf der Plasmamembran und führen somit zur Identifizierung der Zelle.
Der Parasit Trypanosoma brucei kann aufgrund seiner variablen Membranproteine (variant surface glycoproteins, VSG) nicht vom Immunsystem des Wirts erkannt werden, was durch die sogenannten VSG-GPI-Anker ermöglicht werden kann.
GPI-verankerte Proteine konnten durch eine Phospholipase nachgewiesen werden, die speziell inositolhaltige Phospholipide spaltet.[1]
Weiterhin wurde nachgewiesen, dass GPI-Anker ein Trimannose-Glucosamin-Inosit-Rückgrat besitzen.
Literatur
- Isabelle Flury: Glycosylphosphatidylinositol Membrane Anchors in Saccharomyces cerevisiae: Characterization of Proteins Involved in Side Chain Modifications. (PDF; 5,9 MB), Dissertation. Universität Freiburg in der Schweiz, 2001.
Einzelnachweise
- Gerald Karp, Kurt Beginnen: Molekulare Zellbiologie. Springer, 2005, ISBN 3-540-27466-9, S. 157–230.