Caspasen
Caspasen (englisch cysteinyl-aspartate specific protease) sind eine Gruppe von Cysteinproteasen, die Zielproteine an einer Peptidbindung C-Terminal von Aspartat schneiden, woher der Name stammt. Caspasen sind bei Tieren die wichtigsten Enzyme der Apoptose, des programmierten Zelltods.
| Caspasen | ||
|---|---|---|
| Enzymklassifikation | ||
| EC, Kategorie | 3.4.22.-, Cysteinprotease | |
| MEROPS | C14 | |
| Reaktionsart | Asp-/- | |
Eigenschaften
Caspasen sind essentiell für die korrekte Entwicklung eines Lebewesens, aber auch für die Antwort einer Zelle auf schwere Beschädigung (z. B. durch Strahlung) oder auf eine Infektion durch intrazelluläre Pathogene wie z. B. Viren.
Die Caspasen sind Bestandteil einer Enzymkaskade bei der Einleitung der Apoptose.[1] Zum Auslösen des Zelltods werden zuerst Initiator-Caspasen (z. B. Caspase-8 und 9) aktiviert. Diese wiederum spalten die pro-Form (Vorläuferform) nachgeschalteter Caspasen (Effektor-Caspasen, unter anderem Caspase 3, 7, 6), die zelleigene Proteine wie unter anderem Aktin und Lamin spalten. Eine weitere wichtige Funktion der Effektor-Caspasen ist die Aktivierung einer Nuklease, die im Rahmen der Apoptose die nukleäre DNA zwischen den Histonen spaltet, wodurch sich in einer Agarose-Gelelektrophorese eine DNA-Leiter zeigt.
Neben der Apoptose sind Caspasen an der Entwicklung von Erythrozyten und Myoblasten,[2] und bei der synaptischen Plastizität involviert.[3]
Defekte an Caspasen sind an der Entstehung von Tumoren beteiligt.[4][5][6] Manche Viren und intrazellulär lebende Bakterien versuchen im Zuge einer Immunevasion eine Caspase-Aktivierung zu unterbinden.[7][8] Manche Viren verwenden Caspasen zur Aktivierung ihrer eigenen Proteine.[9] Weitere Krankheiten mit Störungen der Caspasekaskade sind z. B. Proteinfehlfaltungserkrankungen wie Morbus Alzheimer[10], Morbus Parkinson, Chorea Huntington[10] und amyotrophe Lateralsklerose, sowie Schlaganfall, Ischämie, Herzinsuffizienz, systemischer Lupus erythematodes, autoimmunes lymphoproliferatives Syndrom, rheumatoide Arthritis und Thyroiditis.[11]
Typen
Beim Menschen wurden bisher zwölf verschiedene Caspasen beschrieben.[12] Diese werden in drei Gruppen eingeteilt: Proinflammatorische Caspasen, Initiator-Caspasen und Effektor-Caspasen. Initiator-Caspasen (z. B. CASP2,[13] CASP8, CASP9 und CASP10) schneiden Effektor-Caspasen in ihre aktive Form. Effektor-Caspasen (z. B. CASP3, CASP6, CASP7) schneiden dagegen andere zelluläre Proteine der Apoptose. Die Aktivierung wird durch Caspase-Inhibitoren gehemmt. Weiterhin spielt Casp6 eine Rolle bei der Derepression des Immunsystems in der frühen Phase der Infektion[14][15] und bei der Spaltung von Huntingtin bei Morbus Huntington und Amyloid-Precursor-Protein bei Morbus Alzheimer.[10]
CASP1, CASP4 und CASP5 sind inflammatorische Caspasen und an der Reifung von T-Zellen beteiligt. Casp4 und Casp5 sind bei manchen Formen von Vitiligo und verwandten NALP1-assoziierten Autoimmunerkrankungen überexprimiert.[16]
Caspasekaskade
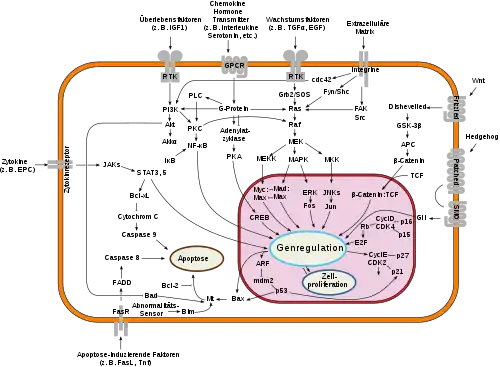
Die Aktivität der Caspasen wird nicht durch Änderung der Genexpression aktiviert, sondern durch posttranslationale Modifikation über Proteolysen. Initiator-Caspasen schneiden weitere Caspasen in ihre aktive Form, wodurch sich eine exponentielle Signalverstärkung ergibt. Durch die proteolytische Aktivierung der Caspasen werden in Folge zunehmend weitere Proteine zerlegt. Dadurch kann die Apoptose schneller eingeleitet werden. Bei Initiator-Caspasen sind die abzutrennenden Prodomänen länger als bei Effektor-Caspasen. Die Prodomäne der Initiator-Caspasen enthält eine CARD-Domäne (z. B. Caspase-2 und -9) oder eine Death effector domain (DED) (bei Caspase-8 und -10). Bei einer Aktivierung gruppieren sich die Initiator-Caspasen zusammen und aktivieren sich durch gegenseitige Proteolyse zusätzlich.
Die Initiator-Caspasen können durch verschiedene Enzyme aktiviert werden:
- Granzym B wird von zytotoxischen T-Zellen und NK-Zellen ausgeschüttet, wodurch Caspase-3 und -7 aktiviert wird.
- death receptors wie Fas-Rezeptoren, TRAIL-Rezeptoren und TNF-Rezeptoren, welche Caspase-8 und -10 aktivieren.
- Das Apoptosom (reguliert durch Cytochrom c und die Bcl-2-Familie)[17] aktiviert die Caspase-9.
Die Effektor-Caspasen schneiden verschiedene zelluläre Proteine:
- Lamine
- ICAD/DFF45 (inhibitor of caspase activated DNase or DNA fragmentation factor 45)
- PARP (Poly-ADP-ribose-Polymerase)
- PAK2 (P 21-activated kinase 2)
Das Protein ICAD/DFF45 hemmt die Caspase-activated DNase(CAD). Eine Proteolyse durch Effektor-Caspasen inaktiviert diese Hemmung, wodurch die DNA in der Zelle fragmentiert wird. Die Caspase-1 und -3 in Makrophagen werden durch die DNA-bindenden Proteine HIN-200 (synonym p202) gehemmt bzw. durch AIM2 (synonym p210) aktiviert.[18]
Geschichte
H. Robert Horvitz entdeckte die Beteiligung des Gens ced-3 (von Caenorhabditis elegans death gene) am programmierten Zelltod.[19] Horvitz und seine Mitarbeiterin Junying Yuan entdeckten 1993 die Ähnlichkeit von ced-3 zu der Cysteinprotease von Säugern interleukin-1-beta converting enzyme (ICE, heute als Caspase-1 bekannt).[20][21] Die Nomenklatur der Caspasen wurde 1996 verabschiedet,[22] da aufgrund der zeitgleichen Entdeckung in mehreren Forschergruppen oftmals unterschiedliche Bezeichnungen verwendet wurden, z. B. war Caspase 3 als CPP32, Apopain und Yama beschrieben. Die Caspasen wurden in der Reihenfolge ihrer Entdeckung umbenannt.
Weblinks
- Jennifer McDowall/Interpro: Protein Of The Month: Caspases. (engl.)
- MeSH Caspasen
Einzelnachweise
- M. Kurokawa, S. Kornbluth: Caspases and kinases in a death grip. In: Cell. Band 138, Nummer 5, September 2009, S. 838–854, doi:10.1016/j.cell.2009.08.021. PMID 19737514. PMC 3390419 (freier Volltext).
- M. Lamkanfi, et al.: Caspases in cell survival, proliferation and differentiation. In: Cell Death and Differentiation. 14, Nr. 1, Januar 2007, S. 44–55. doi:10.1038/sj.cdd.4402047. PMID 17053807. Abgerufen am 28. Februar 2011.
- Z. Li, M. Sheng: Caspases in synaptic plasticity. In: Molecular brain. Band 5, 2012, S. 15, doi:10.1186/1756-6606-5-15. PMID 22583788. PMC 3366905 (freier Volltext).
- M. V. Fiandalo, N. Kyprianou: Caspase control: protagonists of cancer cell apoptosis. In: Experimental oncology. Band 34, Nummer 3, Oktober 2012, S. 165–175, PMID 23070001. PMC 3721730 (freier Volltext).
- M. Olsson, B. Zhivotovsky: Caspases and cancer. In: Cell death and differentiation. Band 18, Nummer 9, September 2011, S. 1441–1449, doi:10.1038/cdd.2011.30. PMID 21455218. PMC 3178435 (freier Volltext).
- E. Frejlich, J. Rudno-Rudzińska, K. Janiszewski, L. Salomon, K. Kotulski, O. Pelzer, Z. Grzebieniak, R. Tarnawa, W. Kielan: Caspases and their role in gastric cancer. In: Advances in clinical and experimental medicine : official organ Wroclaw Medical University. Band 22, Nummer 4, 2013 Jul-Aug, S. 593–602, PMID 23986221.
- A. M. Fuentes-González, A. Contreras-Paredes, J. Manzo-Merino, M. Lizano: The modulation of apoptosis by oncogenic viruses. In: Virology journal. Band 10, 2013, S. 182, doi:10.1186/1743-422X-10-182. PMID 23741982. PMC 3691765 (freier Volltext).
- N. H. Philip, I. E. Brodsky: Cell death programs in Yersinia immunity and pathogenesis. In: Frontiers in cellular and infection microbiology. Band 2, 2012, S. 149, doi:10.3389/fcimb.2012.00149. PMID 23226685. PMC 3510641 (freier Volltext).
- A. Richard, D. Tulasne: Caspase cleavage of viral proteins, another way for viruses to make the best of apoptosis. In: Cell death & disease. Band 3, 2012, S. e277, doi:10.1038/cddis.2012.18. PMID 22402601. PMC 3317351 (freier Volltext).
- Rona K. Graham, Dagmar E. Ehrnhoefer, Michael R. Hayden: Caspase-6 and neurodegeneration. In: Trends in Neurosciences. Band 34, Nr. 12, 1. Dezember 2011, S. 646–656, doi:10.1016/j.tins.2011.09.001, PMID 22018804.
- B. Favaloro, N. Allocati, V. Graziano, C. Di Ilio, V. De Laurenzi: Role of apoptosis in disease. In: Aging. Band 4, Nummer 5, Mai 2012, S. 330–349, PMID 22683550. PMC 3384434 (freier Volltext).
- HUGO Gene Nomenclature Committee (Memento des Originals vom 8. September 2013 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.
- L. L. Fava, F. J. Bock, S. Geley, A. Villunger: Caspase-2 at a glance. In: Journal of cell science. Band 125, Pt 24Dezember 2012, S. 5911–5915, doi:10.1242/jcs.115105. PMID 23447670.
- Hiroshi Kobayashi, Anna Nolan, Bushra Naveed, Yoshihiko Hoshino, Leopoldo N. Segal: Neutrophils Activate Alveolar Macrophages by Producing Caspase-6–Mediated Cleavage of IL-1 Receptor-Associated Kinase-M. In: The Journal of Immunology. Band 186, Nr. 1, 1. Januar 2011, S. 403–410, doi:10.4049/jimmunol.1001906, PMID 21098228 (jimmunol.org [abgerufen am 12. Juli 2017]).
- Alexander Bartel, André Göhler, Verena Hopf, Katrin Breitbach: Caspase-6 mediates resistance against Burkholderia pseudomallei infection and influences the expression of detrimental cytokines. In: PLOS ONE. Band 12, Nr. 7, 7. Juli 2017, S. e0180203, doi:10.1371/journal.pone.0180203 (plos.org [abgerufen am 12. Juli 2017]).
- P.K. Gregersen: Modern genetics, ancient defenses, and potential therapies. In: N Engl J Med.. 356, Nr. 12, 22. März 2007, S. 1263–6. doi:10.1056/NEJMe078017. PMID 17377166.[PMID 17377166]
- P. Li, et al.: Mitochondrial Activation of Apoptosis. In: Cell. 116, Nr. 2 Suppl, Januar 2004, S. 57–59. doi:10.1016/S0092-8674(04)00031-5. PMID 15055583. Abgerufen am 6. November 2006.
- T. L. Roberts, A. Idris, J. A. Dunn, G. M. Kelly, C. M. Burnton, S. Hodgson, L. L. Hardy, V. Garceau, M. J. Sweet, I. L. Ross, D. A. Hume, K. J. Stacey: HIN-200 proteins regulate caspase activation in response to foreign cytoplasmic DNA. In: Science. Band 323, Nummer 5917, Februar 2009, S. 1057–1060, doi:10.1126/science.1169841. PMID 19131592.
- N. N. Danial, Korsmeyer, S. J.: Cell Death: Critical Control Points. In: Cell. 116, Nr. 2, Januar 2004, S. 205–219. doi:10.1016/S0092-8674(04)00046-7. PMID 14744432. Abgerufen am 6. November 2006.
- Yuan, J et al.: The C. elegans cell death gene ced-3 encodes a protein similar to mammalian interleukin-1 beta-converting enzyme. In: Cell. 75, Nr. 4, 1993, S. 641–652. doi:10.1016/0092-8674(93)90485-9. PMID 8242740.
- J. Yuan, Horvitz, H. R.: A First Insight into the Molecular Mechanisms of Apoptosis. In: Cell. 116, Nr. 2 Suppl, Januar 2004, S. 53–56. doi:10.1016/S0092-8674(04)00028-5. PMID 15055582. Abgerufen am 6. November 2006.
- E. S. Alnemri, D. J. Livingston, D. W. Nicholson, G. Salvesen, N. A. Thornberry, W. W. Wong, J. Yuan: Human ICE/CED-3 protease nomenclature. In: Cell. Band 87, Nummer 2, Oktober 1996, S. 171, PMID 8861900.