Trichoplax adhaerens
Trichoplax adhaerens ist die einzige allgemein anerkannte Art der Placozoa.[1] Der Organismus wurde 1883 von dem deutschen Zoologen Franz Eilhard Schulze in einem Meerwasser-Aquarium des Zoologischen Instituts in Graz entdeckt. Der von ihm verliehene Gattungsname des Tiers leitet sich aus dem altgriechischen θρίξ thrix „Haar“ und πλάξ plax „Platte“ ab, das lateinische Artepithet adhaerens bedeutet „haftend“, so dass sich der Artenname etwa mit „anhaftende haarige Platte“ übersetzen lässt.
| Trichoplax adhaerens | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
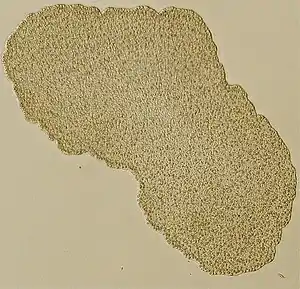
Lichtmikroskopisches Bild von Trichoplax | ||||||||||
| Systematik | ||||||||||
| ||||||||||
| Wissenschaftlicher Name des Stamms | ||||||||||
| Placozoa | ||||||||||
| Grell, 1971 | ||||||||||
| Wissenschaftlicher Name der Gattung | ||||||||||
| Trichoplax | ||||||||||
| F. E. Schulze, 1883 | ||||||||||
| Wissenschaftlicher Name der Art | ||||||||||
| Trichoplax adhaerens | ||||||||||
| F. E. Schulze, 1883 |
Die Placozoa oder Plattentiere sind die strukturell einfachsten aller vielzelligen Tiere (Metazoa) und bilden einen eigenen Tierstamm. Der wissenschaftliche Name bedeutet wörtlich übersetzt „flache Tiere“, im Deutschen wird gelegentlich der Name Scheibentiere verwendet. Anhand genetischer Daten gilt es als sicher, dass die Placozoa zahlreiche Arten umfassen. Da sie sich aber morphologisch nicht unterscheiden lassen, wurde bisher nur Trichoplax adhaerens als einzige Art beschrieben.[2]
Lange Zeit hielt man die bisher nicht in ihrem natürlichen Lebensraum beobachteten Tiere für Jugendstadien von Nesseltieren (Cnidaria): Länger als ein halbes Jahrhundert wurden sie als Planula-Larven der Hydrozoen-Art Eleutheria krohni gedeutet. Erst Arbeiten aus den 1970er Jahren, unter anderem durch den Tübinger Protozoologen Karl G. Grell, klärten die frühen Phasen der Embryonalentwicklung der Tiere auf und trugen maßgeblich zur Errichtung eines eigenen Tierstamms für sie bei.
Aufbau
Placozoa haben, wie ihr Name andeutet, in der Regel einen stark abgeflachten, scheibenförmigen Körper. Er misst im Durchmesser in den meisten Fällen weniger als einen halben Millimeter. Vereinzelt erreichen Exemplare Größen von 2 bis 3 Millimetern – selten mehr. Die Scheibendicke beträgt meistens nur etwa 25 Mikrometer. Mit bloßem Auge sind die gräulich gefärbten, im Gegenlicht transparenten Tiere meist gerade noch zu erkennen. Oberflächlich sehen sie wie große Amöben aus und ändern wie diese beständig ihre äußere Form. Selten treten daneben kugelförmige Lebensstadien auf, die möglicherweise dem passiven Transport in neue Lebensräume dienen.
Wie die Zuordnung zu den Gewebelosen schon andeutet, fehlen Trichoplax adhaerens Gewebe und Organe; es gibt auch keine ausgeprägte Körpersymmetrie, so dass sich weder vorne oder hinten noch links oder rechts unterscheiden lassen.
Zellen und Zellverbände
Sowohl strukturell als auch funktionell lassen sich bei Trichoplax adhaerens eine Rücken- oder Dorsalseite und eine Bauch- oder Ventralseite unterscheiden. Beide bestehen aus einer einlagigen, nach außen von Schleim bedeckten Zellschicht und erinnern vor allem wegen der zwischen den Zellen bestehenden Verbindungen, der Gürteldesmosomen, an Epithelgewebe. Die Zelllagen der Placozoa besitzen aber im Gegensatz zu einem echten Epithel keine Basallamina; darunter versteht man eine aus extrazellulärem Material bestehende, dem Epithel von innen unterliegende dünne Schicht, die es versteift und vom Innenraum des Körpers abtrennt. Das Fehlen dieser ansonsten bei allen Tieren außer einigen Schwämmen zu findenden Struktur lässt sich funktionell begründen: Eine steife Trennschicht würde die amöboiden Formänderungen von Trichoplax adhaerens unmöglich machen. Um den Unterschied zu betonen, spricht man statt von einem Epithel daher manchmal bei den Placozoa von einem Epitheloid.
Ein ausgewachsenes Individuum besteht aus bis zu tausend Zellen, die sechs verschiedenen Zelltypen[3] zugeordnet werden können (früher waren nur vier bekannt). Die einfach begeißelten Zellen des rückseitigen Epitheloids sind außen abgeflacht und bilden hier einen plattenartigen Zellverband, von dem die Zellkörper ins Innere vorragen, sie enthalten kleine Lipidkörperchen, möglicherweise Abwehrstoffe gegenüber Fressfeinden. Zwischen ihnen befinden sich wenige Zellen mit becherförmigem Zellkern, die einen kristallinen Einschluss enthalten und deshalb Kristallzellen genannt werden; sie könnten eine Funktion als Sinneszellen besitzen. Die Zellen der Bauchseite sind ebenfalls nur einfach begeißelt, sie haben eine langgestreckte säulige Form mit kleinem Querschnitt an der Oberfläche, so dass die Geißeln bauchseitig sehr eng beieinander stehen und eine bewimperte „Kriechsohle“ bilden. Ihre zahlreichen Mikrovilli deuten darauf hin, dass sie auch an der Verdauung von Beute beteiligt sind. Dazwischen, vor allem randlich auf der Ventralseite, befinden sich ebenfalls mit einem Cilium bewimperte Drüsenzellen, die Neuropeptide synthetisieren können. Diese könnten an der Steuerung und Regulation der Bewegung des Tiers beteiligt sein. Ein dritter Typ unbewimperter Zellen, die sogenannten lipophilen Zellen, erstrecken sich mit ihrem Zellkörper weit ins Innere des Organismus, sie sind in der Mitte der Kriechsohle am häufigsten, also genau entgegengesetzt wie die Drüsenzellen verteilt. Vermutlich synthetisieren diese Zellen Verdauungsenzyme.
Zwischen den beiden Zellschichten befindet sich ein flüssigkeitsgefüllter Innenraum, in dem ein lockeres Netzwerk von überwiegend einschichtig angeordneten Faserzellen liegt. Diese bestehen aus dem Zellkörper mit sechs oder mehr langen Fortsätzen, die sich am Ende fein verzweigen. Entgegen früheren Annahmen bilden die Faserzellen wohl kein Synzytium aus.[3] Die Fortsätze ziehen sich zu den Zellen beider Epithelien und zu anderen Faserzellen, sie verknüpfen so alle somatischen Zellen zu einem Netzwerk. Die Kontaktstellen sind morphologisch unspezialisiert, sie bilden keine Synapsen oder ähnliche Bildungen aus. Spärlich in die Faserzellen eingestreute Scheidewände (Septen) könnten aber eine Funktion bei der elektrischen Erregungsleitung besitzen, entsprechende Funktionen sind von ähnlichen Strukturen bei anderen Tierarten bekannt. Stäbchenförmige Einschlüsse könnten endosymbiontische Bakterien unbekannter Funktion sein. Entgegen früheren Annahmen besitzen die Fortsätze keine Myofibrillen, eine Rolle, analog Muskelzellen, bei der Bewegung des Tiers ist damit eher unwahrscheinlich. Ihre Oberfläche trägt nach Immunfluoreszenz-Beobachtungen das Cadherin TaCDH.[3] Es gibt Hinweise darauf, dass unterschiedliche genetische Linien der Placozoa unterschiedliche Faserzellen enthalten.[4]
Soweit bisher bekannt, existiert keine extrazelluläre Matrix wie man sie bei Nesseltieren oder Rippenquallen als Mesogloea oder bei Schwämmen als Mesohyl findet.
Anders als bei den Gewebetieren wurden pluripotente Stammzellen, also solche, die sich in andere Zelltypen umwandeln können, noch nicht eindeutig nachgewiesen.
Genetik
Alle Zellkerne der Placozoa-Zellen enthalten zwölf nur etwa zwei bis drei Mikrometer große Chromosomen. Drei Paare sind metazentrisch, die anderen acrozentrisch, das heißt, das Zentromer, die Ansatzstelle der Spindelfasern bei der Zellteilung, liegt in der Mitte beziehungsweise am äußeren Rand des jeweiligen Chromosoms.[5] Die Zellen des Fasersynzytiums sind eventuell tetraploid, enthalten also einen vierfachen Chromosomensatz.
Insgesamt enthält ein einfacher Chromosomensatz von Trichoplax adhaerens weniger als 50 Millionen Basenpaare (98 Millionen Basenpaare des diploiden Organismus) und bildet damit das kleinste tierische Genom; die Zahl der Basenpaare des Darmbakteriums Escherichia coli ist nur um einen Faktor 10 kleiner. Es werden zwischen 11.000 und 12.000 proteinkodierende Gene abgeschätzt.[6] Im Gegensatz zu anderen Arten mit kleinem Genom ist dasjenige von Trichoplax nicht an Introns verarmt; das ist ein Indiz gegen eine nachträgliche Verkleinerung.
Die genetische Ausstattung von Trichoplax adhaerens ist noch nicht sehr gut erforscht; einige Gene wie Brachyury oder Tbx2/3, die homolog zu entsprechenden Basenpaarsequenzen bei Gewebetieren sind, konnten allerdings bereits nachgewiesen werden. Von besonderer Bedeutung ist Trox-2, ein Placozoa-Gen, das vermutlich den bei Nesseltieren unter dem Namen Cnox-2 und bei den zweiseitig-symmetrischen Bilateria als Gsx bezeichneten Genen homolog ist, es gehört demnach zu den ParaHox-Genen.[7] Als Homöobox- Gen, das zu den Hox-Genen gehört, spielt es in der Embryonalentwicklung bei Gewebetieren eine Rolle bei der Ausbildung und Körperdifferenzierung entlang der Symmetrieachse; bei den Nesseltieren legt es etwa die Lage von Mund- (oraler) und mundabgewandter (aboraler) Seite des Tieres fest. Placozoa besitzen allerdings, wie angesprochen, keine Symmetrieachsen. Im Trichoplax-Körper wird das Gen in einer ringförmigen, den Körper umgebenden Zone abgelesen. Vergleich der Genanordnung anderer Gene auf dem Chromosomenstrang liefert außerdem Indizien dafür, dass Trichoplax wohl ein weiteres, echtes Hox-Gen besessen haben könnte, das später verloren gegangen ist – ein Indiz für eine sekundäre Vereinfachung.[7]
Das Trichoplax-Genom enthält darüber hinaus zahlreiche weitere Gene, die ortholog zu Genen für Transkriptionsfaktoren sind, die bei Bilateriern (wie auch dem Menschen) an der Ausbildung von Körperachsen beteiligt sind, obwohl diese bei den Placozoa nicht differenziert sind. So sind Gene für den Wnt-Signalweg und den BMP/TGF beta Signalweg vorhanden, der bei Bilateria an der Ausbildung der Körperlängsachse und der Dorsal-Ventral-Achse beteiligt ist. Obwohl spezialisierte Nervenzellen nicht ausgebildet sind, sind Proteine für Neurotransmitter und für Nervenzellen typische Ionenkanäle vorhanden. Wie typisch für Mehrzeller (aber auch schon in vielen einzelligen oder Zellkolonien bildenden Kragengeißeltierchen vorhanden) werden Gene für zahlreiche Zelladhäsionsmoleküle gefunden, darunter auch solche, die an Moleküle der extrazellulären Matrix binden, obwohl eine solche in Trichoplax noch nicht sicher nachgewiesen wurde – möglicherweise ist diese doch vorhanden, aber den bisherigen Nachweismethoden entgangen.[6]
Verbreitung und Lebensraum
Genaue Verbreitungsangaben existieren für die Placozoa nicht, die Tiere wurden aber unter anderem im Roten Meer, dem Mittelmeer, der Karibik, vor Hawaii, Guam, Samoa, Japan, Vietnam oder Papua-Neuguinea und am Großen Barriere-Riff vor der australischen Ostküste nachgewiesen. Sie sind, soweit bekannt, in allen tropischen und subtropischen Meeren, nördlich bis zum Mittelmeer, bei Wassertemperaturen zwischen 10 und 32 °C weit verbreitet. Regelmäßig wird Trichoplax adhaerens auch in Meerwasser-Aquarien „gefunden“, so etwa im südenglischen Plymouth oder im US-amerikanischen Bundesstaat Florida in Miami.
Eine direkte Nachsuche im Meer ist für die sehr kleinen und unauffälligen Tiere unmöglich. Zum Nachweis existieren zwei Methoden: Entweder werden Hartsubstrate wie Steine im Lebensraum eingesammelt und später im Aquarium näher untersucht, oder es werden künstliche Substrate, meist Objektträger aus Glas, im Lebensraum exponiert, wobei man auf eine spontane Besiedlung durch die Tiere hofft. Die bisherigen Feldfunde stammen aus Flachwasser der Meeresküsten, bis in eine Tiefe von etwa 20 Meter, und Gezeitenzonen tropischer und subtropischer Meere, wo sich die Tiere auf Substraten wie Stämmen oder Wurzeln von Mangroven, Weichtier-Schalen, Bruchstücken von Steinkorallen oder einfach auf Felsbrocken finden. Sie können sowohl Brackwasser-beeinflusste Lebensräume mit einer Salinität bis 2 % wie auch etwas aufgesalzenes, konzentriertes Meerwasser mit einer Salinität bis über 5 % überleben. Ihre Häufigkeit ist in den Sommermonaten höher.[8] Die Häufigkeit des Vorkommens steigt, nach Modellberechnungen, mit steigender Temperatur und steigender Salinität an, wobei eher nährstoffarmes Wasser bevorzugt wird. Die unterschiedlichen genetischen Linien (die vermutlich verschiedenen Arten entsprechen) zeigen dabei unterschiedliche Vorlieben.[9]
Ernährung
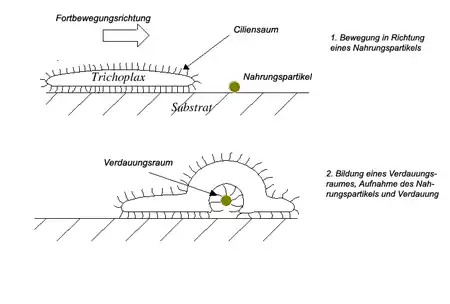
Trichoplax adhaerens ernährt sich von kleinen Algen, insbesondere Grünalgen (Chlorophyta) der Gattung Chlorella, Kryptomonaden (Cryptophyta) der Gattungen Cryptomonas oder Rhodomonas, Cyanobakterien (Cyanobacteria) wie Phormidium inundatum, aber auch von abgestorbenen Teilen anderer Organismen. Dazu bilden sich auf der Bauchseite um die Nahrungspartikel eine oder mehrere kleine Taschen, in die von den Drüsenzellen Verdauungsenzyme abgegeben werden; die Tiere entwickeln also vorübergehend einen „Außenmagen“. Die aufgeschlossenen Nährstoffe werden durch Pinocytose („Zell-Trinken“) von den bauchseitigen Geißelzellen aufgenommen.
Auch über das obere Epitheloid (den „Rücken“ des Tieres) können Nahrungspartikel, auch ganze Einzeller, aufgenommen werden. Diese Ernährungsweise dürfte im Tierreich einmalig sein: In einer Schleimschicht gesammelte Nahrungspartikel werden von Faserzellen durch Interzellular-Spalten (Zellzwischenräume) des Epitheloids gezogen und per Phagocytose („Zell-Essen“) verdaut. Dieses „Einsammeln“ von Nahrungspartikeln durch ein intaktes Abschlussgewebe hindurch ist nur möglich, weil Placozoa verschiedene „abdichtende“ Elemente (eine Basallamina unter dem Epitheloid und bestimmte Zell-Zell-Verbindungen) fehlen.
Symbionten
Mit diesem scheinbar einfachsten Tier leben zwei verschiedene sehr wählerische Bakterien in intrazellulärer Symbiose:
- Das endoplasmatische Retikulum, ein Zellorganell des Fasersynzytiums, dient dem Aufbau von Proteinen und Membranen. Dieses wird besiedelt von einem zur Ordnung der Rickettsiales gezählten Bakterium, provisorisch benannt als Candidatus Grellia incantans. Anhand seiner Genexpression geht man davon aus, dass es die meisten seiner Nährstoffe vom Wirtsorganismus bezieht.
- Candidatus Ruthmannia eludens, ein Vertreter des provisorischen, bisher nur nach Sequenzdaten charakterisierten und vermutlich nahe mit den Cyanobakterien verwandten Candidatus-Phylums Margulisbacteria, lebt in Zellen, mit denen Trichoplax die Nahrung verdaut. Ruthmannia eludens verwertet wahrscheinlich Fette und andere Lipide der Algen und kann seinem Wirt Vitamine und Aminosäuren zur Verfügung stellen.[10]
Fortbewegung
Auf fester Oberfläche können sich Placozoa auf zwei verschiedene Arten bewegen: Einmal ermöglicht es ihnen ihre begeißelte Kriechsohle, langsam über den Untergrund hinweg zu gleiten, zum anderen können sie wie eine Amöbe ihre Lage durch Wandlung der Körperform verändern. Die Bewegungen sind dabei nicht zentral koordiniert, da keinerlei Muskel- oder Nervengewebe existiert.
Zwischen Körperform und Fortbewegungsgeschwindigkeit konnte eine enge Verbindung nachgewiesen werden, die zusätzlich abhängig vom Nahrungsangebot ist[11]
- Bei niedriger Nährstoffdichte schwankt die Querschnittsfläche geringfügig, aber unregelmäßig, die Fortbewegungsgeschwindigkeit liegt verhältnismäßig konstant bei etwa 15 Mikrometern pro Sekunde.
- Ist die Nährstoffdichte dagegen hoch, oszilliert der Querschnitt mit einer stabilen Periode von etwa 8 Minuten, wobei die größte Ausdehnung des Tiers bis zu doppelt so groß sein kann wie die kleinste. Die Fortbewegungsgeschwindigkeit, die durchweg unterhalb von 5 Mikrometern pro Sekunde liegt, schwankt mit derselben Periode. Eine große Geschwindigkeit entspricht dabei immer einer kleinen Querschnittsfläche und umgekehrt.
Die beiden Ausbreitungsweisen lassen sich, da der Übergang nicht flüssig, sondern abrupt vonstattengeht, sehr gut gegeneinander abgrenzen. Vereinfachend lässt sich Trichoplax adhaerens als nicht-lineares dynamisches System fern dem thermodynamischen Gleichgewicht modellieren.
Eine qualitative Erklärung für das Verhalten des Tiers ergibt sich wie folgt:
- Bei niedriger Nährstoffdichte behält Trichoplax eine konstante Geschwindigkeit bei, um ohne unnötigen Zeitverlust Nahrungsquellen ausfindig zu machen.
- Ist eine solche Quelle durch hohe Nährstoffdichte identifiziert, erhöht das betreffende Individuum in regelmäßigen Abständen seinen Querschnitt und vergrößert damit die Kontaktfläche mit dem Substrat. Auf diese Weise erweitert sich die Fläche, über die Nährstoffe aufgenommen werden können. Gleichzeitig verringert das Tier seine Geschwindigkeit, um das vorhandene Nahrungsangebot auch tatsächlich auszuschöpfen.
- Sobald dies annähernd geschehen ist, verkleinert Trichoplax seinen Querschnitt wieder, um sich weiterzubewegen. Weil Nahrungsquellen wie Algenteppiche oft eine größere Ausdehnung haben, ist es für ein betroffenes Tier sinnvoll, nach kurzer Zeit in der Bewegung innezuhalten, um sich erneut abzuflachen und Nährstoffe aufzunehmen. Daher bewegt sich Trichoplax in dieser Phase nur verhältnismäßig langsam voran.
Die konkrete Richtung, in die sich Trichoplax jeweils bewegt, ist zufallsbestimmt: Misst man, wie schnell sich ein einzelnes Tier von einem (willkürlich bestimmten) Ausgangspunkt wegbewegt, so findet man eine lineare Beziehung zwischen der vergangenen Zeit und der mittleren quadratischen Entfernung von Start- und aktuellem Aufenthaltsort. Ein solcher Zusammenhang charakterisiert auch die zufallsbestimmte Brownsche Bewegung, die somit als Modell für die Fortbewegung der Placozoa dienen kann.
Kleine Tiere sind auch in der Lage, aktiv mit Hilfe ihrer Geißeln zu schwimmen. Sobald sie ein mögliches Substrat berühren, kommt es zu einer Dorsoventralreaktion: Die Geißeln der Rückseite schlagen weiter, während die Geißeln der bauchseitigen Zellen ihren Schlagrhythmus einstellen. Gleichzeitig versucht die Bauchseite, Kontakt mit dem Untergrund herzustellen; kleine Zellaus- und -einstülpungen, die Mikrovilli, die sich an der Oberfläche der säuligen Zellen der Bauchseite befinden, tragen durch ihre adhäsive (klebende) Wirkung zur Anheftung an das Substrat bei.
Regeneration
Eine bemerkenswerte Eigenschaft der Placozoa ist, dass sie sich aus kleinsten Zellbeständen regenerieren können. Selbst wenn im Experiment große Teile des Organismus entfernt werden, entwickelt sich aus dem Rest wieder ein vollständiges Tier. Es ist darüber hinaus möglich, Trichoplax adhaerens durch ein Passiersieb zu streichen, so dass die Einzelzellen zwar nicht zerstört, aber weitgehend voneinander getrennt werden. Im Reagenzglas finden sie sich dann wieder zu kompletten Organismen zusammen. Wird diese Prozedur mit mehreren vorher angefärbten Tieren gleichzeitig vollzogen, geschieht das Gleiche. In diesem Fall kann es sogar vorkommen, dass Zellen, die vorher zu einem bestimmten Tier gehörten, plötzlich als Teil eines anderen wieder auftauchen.
Fortpflanzung
Normalerweise pflanzen sich die Placozoa ungeschlechtlich fort. Das Tier schnürt sich dazu in der Mitte durch, so dass zwei etwa gleich große Tochtertiere entstehen, die nach der Fission allerdings noch für eine Weile lose verbunden bleiben. Seltener findet man Knospungsvorgänge: Dabei trennen sich von der Rückenseite kleine, im Wasser schwebende Zellkugeln („Schwärmer“) ab, die alle bekannten Zelltypen in sich vereinigen und in der Folge zu einem eigenen Individuum heranwachsen.
Die geschlechtliche Fortpflanzung wird möglicherweise durch eine zu große Populationsdichte, in einigen Fällen durch hohe Wassertemperaturen, ausgelöst, sie ist bisher rätselhaft und im Detail kaum verstanden. Im Labor bilden dabei ausschließlich degenerierende, durch Wasseraufnahme anschwellende Individuen binnen vier bis sechs Wochen Eizellen aus. Diese werden vermutlich aus Zellen des unteren Epithels gebildet und wachsen ins Innere des Organismus aus. Dabei schwellen sie durch Aufnahme von Nährstoffen und (extern gebildetem) Dotter durch Phagocytose aus dem sich auflösenden mütterlichen Organismus bis zu einer Größe von 70–120 µm an. Die meisten Individuen bilden nur eine einzige Eizelle, selten kommen bis zu drei vor. Gleichzeitig gebildete, sogenannte F-Zellen stellen möglicherweise die männlichen Geschlechtszellen (Spermien) dar[12], doch wurde weder die Funktion bestätigt noch der Befruchtungsvorgang bisher beobachtet; allerdings werden einige für Spermien typische Proteine in den Zellen exprimiert. Nach der (angenommenen) Befruchtung bildet die Eizelle die sogenannte Befruchtungsmembran, eine schützende Hülle. Die Embryonalentwicklung beginnt mit einer vollständigen, äqualen Furchung. Die jungen Embryonen wachsen im mütterlichen Organismus heran, sie werden durch dessen Degeneration und Auflösung freigesetzt.[13]
Trotz erheblicher Anstrengungen ist es bisher nie gelungen, Embryonen jenseits des 128-Zell-Stadiums am Leben zu erhalten. Die weitere Entwicklung ist daher unbekannt. Vermutlich fehlt in der Laborumgebung ein bisher unverstandener kritischer Faktor des natürlichen Lebensraums.
Wegen der Möglichkeit, sich unbegrenzt durch ungeschlechtliche Fortpflanzung zu klonen, ist die Lebensspanne der Placozoa potentiell unendlich; in der Praxis werden einige Entwicklungslinien, die auf ein einziges Tier zurückgehen, seit längerem – in einem Fall seit 1969 – ohne Auftreten sexueller Prozesse in Kultur gehalten.[14]
Stammesgeschichte, Phylogenie
Die stammesgeschichtlichen Verwandtschaftsverhältnisse der Placozoa sind umstritten. Fossile Nachweise existieren nicht und sind auch nicht zu erwarten, so dass die Stellung von Trichoplax adhaerens allein aufgrund des Vergleichs rezenter Arten erschlossen werden muss. Die Placozoa sind neben den Schwämmen (Porifera), den Nesseltieren (Cnidaria), den Rippenquallen (Ctenophora) und den Zweiseitentieren (Bilateria) eine der fünf grundlegenden Entwicklungslinien der vielzelligen Tiere (als Taxon Metazoa genannt). Das Verhältnis dieser fünf Gruppen zueinander ist wissenschaftlich umstritten. Zum Verhältnis von 5 Taxa bestehen theoretisch 105 Möglichkeiten der Abstammungsverhältnisse, zahlreiche davon sind als Hypothese schon vorgeschlagen worden. Die bisher erzielten Ergebnisse, von denen einige als zunächst gut abgesichert erschienen, erwiesen sich als stark von der verwendeten Methode und der Anzahl und Zusammensetzung der jeweils einbezogenen Taxa abhängig und gelten damit alle als unsicher.[15][16]
Die Zuordnung zu den Gewebelosen Tieren („Parazoa“) beruht nicht auf den angenommenen Verwandtschaftsbeziehungen der Placozoa, sondern klassifiziert die Tiere stattdessen nach ihrem Organisationsgrad: Ebenso wie den Schwämmen (Porifera), mit denen sie in diesem Taxon vereinigt sind, fehlen ihnen Gewebe oder Organe; das Epitheloid wird in diesem Zusammenhang nicht als vollwertiges Gewebe angesehen. Allerdings sind dies „primitive Merkmale“, so genannte Symplesiomorphien, die auf die gemeinsame Stammart aller Tiere zurückgehen und daher nach Ansicht der phylogenetischen Systematik keine evolutionäre Verwandtschaft begründen können. Andere Biologen sehen darin Rückbildungen, die Tiere wären also sekundär vereinfachte Nachkommen komplizierter organisierter Vorfahren.
Placozoa als Schwestergruppe der anderen Metazoa
Aufgrund ihres einfachen Aufbaus werden die Placozoa manchmal als Modellorganismen für die Entwicklung von Einzellern zu Vielzellern angesehen. Sie gelten dann als Schwestergruppe aller anderen Vielzeller:
| Vielzellige Tiere (Metazoa) |
| ||||||||||||
Ein wichtiges Argument für eine solche basale Stellung der Placozoa ist, neben ihrer morphologisch einfachen Organisation, der Aufbau der mitochondrialen DNA, des eigenständigen Erbguts der Mitochondrien. Diese ist, wie bei vielen Einzellern, äußerst komplex aufgebaut, weitaus komplizierter als diejenige aller anderen Vielzeller, unter Einschluss der Schwämme.[17] Phylogenomische Studien, bei denen die Verwandtschaftsverhältnisse anhand des Vergleichs homologer DNA-Sequenzen der mtDNA analysiert worden sind, erwiesen sich aber als nicht sehr erhellend.[18] Vermutlich ist die DNA der Mitochondrien aufgrund zu vieler Mutationen nicht mehr phylogenetisch informativ genug. Genetische Studien, die ein Schwestergruppen-Verhältnis der Placozoa zu den anderen Metazoa aufzeigten gelten daher als sehr unsicher und kaum verlässlich.[19]
Epitheliozoa-Hypothese
Das wichtigste, auf rein morphologischen Eigenschaften beruhende Konzept sieht die Placozoa als nächste Verwandte der Gewebetiere (Eumetazoa). Das gemeinsame, als Epitheliozoa bezeichnete Taxon wird seinerseits als Schwestergruppe der Schwämme (Porifera) aufgefasst:[20]
| Vielzellige Tiere (Metazoa) |
| ||||||||||||||||||
Für ein solches Verhältnis sprechen in erster Linie spezielle Zell-Zell-Verbindungen, die Gürteldesmosomen, die nicht nur bei den Placozoa, sondern bei allen Tieren außerhalb der Schwämme vorkommen und dafür sorgen, dass sich Zellen zu einer lückenlosen Schicht wie dem Epitheloid der Placozoa zusammenschließen können. Das dorsale Epitheloid wird der Hypothese gemäß als homolog zum Ektoderm, das ventrale zum Entoderm der anderen Metazoa aufgefasst. Auch die auf der Bauchseite auftretenden Drüsenzellen teilt Trichoplax adhaerens mit den meisten Gewebetieren. Beide Eigenschaften können als Apomorphien, also als evolutionär abgeleitete Merkmale, gelten und begründen so ein gemeinsames Taxon aller betroffenen Tiere.
Eumetazoa-Hypothese
Eine dritte, in erster Linie molekulargenetisch begründete Hypothese sieht die Placozoa als stark vereinfachte Gewebetiere. Demnach stammt Trichoplax adhaerens von wesentlich komplexer aufgebauten Tieren ab, die bereits über Muskeln und Nervengewebe verfügten. Beide Gewebetypen wie auch die Basallamina des Epithels sind demzufolge erst durch radikale sekundäre Vereinfachung verloren gegangen.
Verschiedene Studien kommen dabei derzeit zu unterschiedlichen Ergebnissen hinsichtlich der genauen Schwestergruppe: Mal gelten die Placozoa als nächste Verwandte der Nesseltiere (Cnidaria), mal als Schwestergruppe der Rippenquallen und gelegentlich werden sie sogar direkt neben die zweiseitig-symmetrischen Bilateria gestellt:
| Vielzellige Tiere (Metazoa) |
| ||||||||||||||||||||||||
Lediglich eine ebenfalls vorgeschlagene Einordnung in die Nesseltiere lässt sich derzeit mit hoher Wahrscheinlichkeit ausschließen.
Kritisch wird gegen das vorgeschlagene Szenario eingewandt, dass es morphologische Merkmale der Tiere vollkommen unberücksichtigt lässt. Eine so extreme Vereinfachung, wie sie dem Modell gemäß für die Placozoa postuliert werden müsste, ist zudem nur von parasitisch lebenden Organismen bekannt, ließe sich aber für eine frei lebende Tierart wie Trichoplax adhaerens nur schwer funktional erklären.
Systematik
Derzeit wird nur eine einzige Art, Trichoplax adhaerens, als Bestandteil der Placozoa anerkannt. Allerdings wurde 1893 durch den Italiener Francesco Saverio Monticelli eine weitere Art mit dem Namen Treptoplax reptans beschrieben, die er in den Gewässern um Neapel fand. Sie gilt jedoch seit 1896 als verschollen; ihre Existenz wird heute von den meisten Zoologen angezweifelt.[1]
Weil zwischen Vertretern von Trichoplax adhaerens oft große genetische Unterschiede bestehen, die bei anderen Organismengruppen zu einer Einteilung in unterschiedliche Gattungen führen würden, erscheint es sehr wahrscheinlich, dass die nach morphologischen Kriterien einzige Art tatsächlich einer Gruppe kryptischer, also äußerlich nicht unterscheidbarer Arten entspricht. Tatsächlich wurden, nach elektronenmikroskopischen Untersuchungen, auch erste morphologische Unterschiede zwischen verschiedenen im Labor kultivierten Klonen angegeben. Bisher sind etwa 200 unterschiedliche genetische Linien, teilweise mit weiter geographischer Verbreitung, nachgewiesen worden, die möglicherweise etwa 20–30 Arten entsprechen könnten. Das Problem der Artabgrenzung bei der merkmalsarmen Gruppe ist aber derzeit noch ungelöst. Auch von der Zuweisung höherer Ränge der rangbasierten (Linné’schen) Taxonomie, wie Familien oder Ordnungen, wird derzeit in der Regel als unzweckmäßig abgesehen.[8]
Erstbeschreibungen
- Placozoa
- Karl Gottlieb Grell: Trichoplax adhaerens F. E. Schulze und die Entstehung der Metazoen. In: Naturwissenschaftliche Rundschau. 22, 1971. S. 160–161. ISSN 0028-1050
- Treptoplax reptans
- Francesco Saverio Monticelli: Treptoplax reptans n.g., n.sp. In: Atti della Reale Accademia dei Lincei, Serie Quinta, Rendiconti, Classe di scienze fisiche, matematiche e naturali 5, 1893, S. 39–40. ISSN 0001-4435
- Trichoplax adhaerens
- Franz Eilhard Schulze: Trichoplax adhaerens, nov. gen., nov. spec. Zoologischer Anzeiger 6 (132), 1883: 92–97. Leipzig, Wilhelm Engelmann Verlag.[21]
Weblinks
- Beobachtungsbericht mit Bild (englisch)
- Kurzbeschreibung mit Bild (englisch)
Einzelnachweise
- Eitel, M. (2011): Trichoplax Schultze, 1883. In: Schierwater, B.; Eitel, M.; DeSalle, R. (2017). World Placozoa Database. Accessed through: World Register of Marine Species, abgerufen am 4. April 2017.
- Rüdiger Wehner, Walter Gehring: Zoologie. 24. Auflage, Thieme, Stuttgart, Juni 2007, S. 696.
- Carolyn L. Smith, Frédérique Varoqueaux, Maike Kittelmann, Rita N. Azzam, Benjamin Cooper, Christine A. Winters, Michael Eitel, Dirk Fasshauer, Thomas S. Reese (2014): Novel Cell Types, Neurosecretory Cells, and Body Plan of the Early-Diverging Metazoan Trichoplax adhaerens. Current Biology 24: 1565–1572. doi:10.1016/j.cub.2014.05.046
- Loretta Guidi, Michael Eitel, Erica Cesarin, Bernd Schierwater, Maria Balsamo (2011): Ultrastructural Analyses Support Different Morphological Lineages in the Phylum Placozoa Grell, 1971. Journal of Morphology 272: 371–378. doi:10.1002/jmor.10922
- V.J. Birstein (1989): On the karyotype of Trichoplax sp. (Placozoa). Biologisches Zentralblatt 108 (1): 63–67.
- Mansi Srivastava, Emina Begovic, Jarrod Chapman, Nicholas H. Putnam, Uffe Hellsten, Takeshi Kawashima, Alan Kuo, Therese Mitros, Asaf Salamov, Meredith L. Carpenter, Ana Y. Signorovitch, Maria A. Moreno, Kai Kamm, Jane Grimwood, Jeremy Schmutz, Harris Shapiro, Igor V. Grigoriev, Leo W. Buss, Bernd Schierwater, Stephen L. Dellaporta, Daniel S. Rokhsar (2008): The Trichoplax Genome and the Nature of Placozoans. Nature 454: 955–960. doi:10.1038/nature07191
- Olivia Mendivil Ramos, Daniel Barker, David E.K. Ferrier (2012): Ghost Loci Imply Hox and ParaHox Existence in the Last Common Ancestor of Animals. Current Biology 22 (20): 1951–1956. doi:10.1016/j.cub.2012.08.023
- Michael Eitel, Hans-Jürgen Osigus, Rob DeSalle, Bernd Schierwater (2013): Global Diversity of the Placozoa. PLoS ONE 8(4): e57131 doi:10.1371/journal.pone.0057131
- Omid Paknia & Bernd Schierwater (2015): Global Habitat Suitability and Ecological Niche Separation in the Phylum Placozoa. PLoS ONE 10(11): e0140162. doi:10.1371/journal.pone.0140162
- Harald R. Gruber-Vodicka, Nikolaus Leisch, Manuel Kleiner, Tjorven Hinzke, Manuel Liebeke, Margaret McFall-Ngai, Michael G. Hadfield, Nicole Dubilier: Two intracellular and cell type-specific bacterial symbionts in the placozoan Trichoplax H2. (2019). Nature Microbiology 4: 1465–1474. doi:10.1038/s41564-019-0475-9
- T. Ueda, S. Koga, Y. K. Marayama: Dynamic patterns in the locomotion and feeding behaviour by the placozoan Trichoplax adhaerens. In: BioSystems 54, 1999, 65–70. doi:10.1016/S0303-2647(99)00066-0
- Karl G. Grell & Gertrud Benwitz (1981): Ergänzende Untersuchungen zur Ultrastruktur von Trichoplax adhaerens F.E. Schulze (Placozoa). Zoomorphology 98(1): 47–67.
- Michael Eitel, Loretta Guidi, Heike Hadrys, Maria Balsamo, Bernd Schierwater (2011): New Insights into Placozoan Sexual Reproduction and Development. PLoS ONE 6(5): e19639. doi:10.1371/journal.pone.0019639
- Bernd Schierwater (2005): My favorite animal, Trichoplax adhaerens. BioEssays 27: 1294–1302.
- Bernd Schierwater, Peter W.H. Holland, David J. Miller, Peter F.Stadler, Brian M. Wiegmann, Gert Wörheide, Gregory A. Wray, Rob DeSalle (2016): Never Ending Analysis of a Century Old Evolutionary Debate: “Unringing” the Urmetazoon Bell. Frontiers in Ecology and Evolution 4:5. doi:10.3389/fevo.2016.00005
- Martin Dohrmann & Gert Wörheide (2013): Novel Scenarios of Early Animal Evolution—Is It Time to Rewrite Textbooks? Integrative and Comparative Biology 53 (3): 503–511. doi:10.1093/icb/ict008
- Stephen L. DellaPorta, Anthony Xu, Sven Sagasser, Wolfgang Jakob, Maria A. Moreno, Leo W. Buss, Bernd Schierwater (2006): Mitochondrial genome of Trichoplax adhaerens supports Placozoa as the basal lower metazoan phylum. PNAS Proceedings of the National Academy of Sciences USA 103 (23): 8751–8756. doi:10.1073/pnas.0602076103
- Fernanda Britto da Silva, Valéria C. Muschner, Sandro L. Bonatto (2007): Phylogenetic position of Placozoa based on large subunit (LSU) and small subunit (SSU) rRNA genes. Genetics and Molecular Biology 30 (1): 127–132. doi:10.1590/S1415-47572007000100022
- Tetyana Nosenko, Fabian Schreiber, Maja Adamska, Marcin Adamski, Michael Eitel, Jörg Hammel, Manuel Maldonado, Werner E.G. Müller, Michael Nickel, Bernd Schierwater, Jean Vacelet, Matthias Wiens, Gert Wörheide (2013): Deep metazoan phylogeny: When different genes tell different stories. Molecular Phylogenetics and Evolution 67 (1): 223–233. doi:10.1016/j.ympev.2013.01.010
- Peter Ax: Multicellular Animals: A new Approach to the Phylogenetic Order in Nature. Volume 1. Springer, Berlin/Heidelberg, 2012. ISBN 978 3642801143. Epitheliozoa auf Seite 77.
- Franz Eilhard Schulze: Trichoplax adhaerens, nov. gen., nov. spec. Zoologischer Anzeiger 6 (132), 1883: 92–97 digitalisiert online, bei archive.org