Cyanazid
Cyanazid ist eine thermisch instabile Kohlenstoff-Stickstoff-Verbindung mit einem Stickstoffgehalt von 82,35 %. Sie kann den Stoffgruppen der Azide sowie der Nitrile zugeordnet werden kann. Es wird in der organischen Synthese als Reagenz für Cycloadditions- und Einschubreaktionen mit Alkenen verwendet.[3]
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
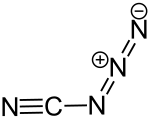 | |||||||||||||
| Allgemeines | |||||||||||||
| Name | Cyanazid | ||||||||||||
| Summenformel | N3CN | ||||||||||||
| Kurzbeschreibung | |||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 68,04 g·mol−1 | ||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||
| Siedepunkt | |||||||||||||
| Löslichkeit |
löslich in Acetonitril, Ethylacetat, Methylenchlorid, Benzol, Toluol, Cyclohexan[3] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Darstellung und Gewinnung
Cyanazid kann durch die Umsetzung von Natriumazid mit Chlorcyan oder Bromcyan in unpolaren Lösungsmitteln wie Acetonitril, Ethylacetat, Methylenchlorid, Toluol oder Cyclohexan im Temperaturbereich zwischen 10 °C und 25 °C hergestellt werden.[1][2]
Nach Abtrennung der Salze kann die Verbindung destillativ gewonnen werden. Dies muss wegen der hohen Instabilität der Verbindung mit höchster Vorsicht erfolgen bzw. vermieden werden, wenn eine Verwendung in Lösung möglich ist.[2]
Eigenschaften
Cyanazid ist ein farbloses Öl, welches bei schwacher thermischer oder mechanischer Belastung äußerst heftig detonieren kann.[5] Die Handhabung in Lösung ist relativ sicher. Die Verbindung ist in den meisten organischen Lösungsmitteln und in Wasser löslich. In organischen Lösungsmitteln erfolgt eine langsame Zersetzung unter Bildung von Stickstoff. Die Halbwertszeit einer 27%igen Lösung in Acetonitril beträgt bei 25 °C 15 Tage. Die Lösungen in Acetonitril oder Ethylacetat können bei Temperaturen zwischen −20 °C und 0 °C praktisch unzersetzt über ein Jahr gelagert werden. Beim Erwärmen auf 40 °C erfolgt in Wasser eine langsame Hydrolyse zum Carbamazid. In 10%iger Natronlauge wird bei Raumtemperatur langsam das Natriumsalz des 5-Azido-1H-tetrazols gebildet.[1][2] Bei einer Gasphasenpyrolyse bei 200 °C wird über das Cyanonitren als Intermediat und Stickstoffabspaltung das Azodicarbonitril gebildet.[6]
Die Struktur der Verbindung in der Gasphase wurde mittels Gasphasenelektronenbeugungsmessungen untersucht. Das gewinkelte Molekül besitzt einen Bindungswinkel zwischen der Azido- und Cyanogruppe von 114°. Die Cyanogruppe ist mit 175° nicht ganz linear zum Azidostickstoff gebunden.[7]
Verwendung
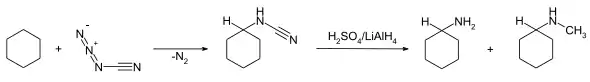
Die Verbindung reagiert mit gesättigten Alkanen unter Stickstoffabspaltung über ein intermediäres Cyanonitren zu Alkylcyanamiden. Diese können mit Reduktionsmitteln wie Lithiumaluminiumhydrid zu den entsprechenden Aminen reduziert werden.[8][9] Untersuchungen an n-Hexan, 2,3-Dimethylbutan, 2,2-Dimethylbutan, Cyclohexan, Cycloheptan und Cyclooctan zeigten, dass die Reaktivität gegenüber C-H-Bindungen von primären zu tertiären Strukturen stark ansteigt.[8][9]
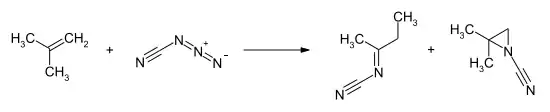
Cyanazid geht mit Alkenen Cycloadditionsreaktionen ein, die sowohl zu Aziridinen und Alkylidencyanamiden führen können. Die Bildung der Alkylidencyanamide erfolgt dabei über cyclische Triazolinintermediate. Das Produktverhältnis hängt von der Struktur der Alkens ab.[3] Mit Isobuten als Ausgangalken werden die Produkte 2-Butylencyanamid und das N-Cyano-2,2-dimethylaziridin im Verhältnis 1,4 : 1 gebildet.[2][10] Mit anderen Alkenen, wie mit Ethen, Propen, 1-Buten, den beiden 2-Butenisomeren, 2-Methyl-but-2-en, 2,3-Dimethyl-2-buten, 3,3-Dimethyl-1-buten oder 2-Hexen wird eine ähnliche Umsetzung mit Bevorzugung der Alkylidencyanamide als Produkt beobachtet.[10]
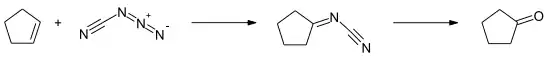
Die Reaktion mit cylischen Alkenen führt im Fall von Cyclopenten nahezu vollständig zum korrespondierenden Imin des Cyanamids, das anschließend zum Cyclopentanon hydrolysiert werden kann. Im Gegensatz dazu ist mit Norbornen das Aziridin das Hauptprodukt.[10]
Mit Cycloalkenen mit trisubstituierter Doppelbindung kann zusätzlich eine Ringverkleinerung wie im Beispiel von 1-Methylcyclohexen zum Cylopentanderivat beobachtet werden.[10] In Gegenwart von Lithiumperchlorat kann bei der Umsetzung von Methylencyclohexanen eine Ringerweiterung zu Cycloheptanderivaten erreicht werden.[11][12]

Bei Umsetzungen bei erhöhter Temperatur wird aus Cyanamid unter Stickstoffabspaltung als Intermediat das Cyanonitren gebildet. Dieses reagiert mit gesättigten Kohlenwasserstoffen zu Alkylcyanamiden.[9] Mit Benzol gelingt die Ringerweiterung zum Cyanoazepin. Diese Reaktion kann auch mit Toluol, p-Xylol, Benzoesäuremethylester, Chlorbenzol, Fluorbenzol Hexafluorbenzol, Trifluormethylbenzol und Benzotrichlorid mit hoher Ausbeute durchgeführt werden.[13]

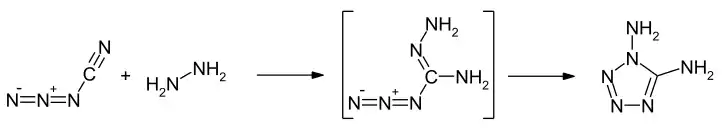
Durch Umsetzung mit Hydrazin ist über eine Azidohydrazozwischenverbindung das 1,5-Diamino-1H-tetrazol zugänglich.[14]
Einzelnachweise
- F. D. Marsh: Cyanogen azide. In: The Journal of Organic Chemistry. 37, Nr. 19, 1972, S. 2966–2969, doi:10.1021/jo00984a012.
- F. D. Marsh, M. E. Hermes: Cyanogen Azide. In: Journal of the American Chemical Society. 86, Nr. 20, 1964, S. 4506–4507, doi:10.1021/ja01074a071.
- Encyclopedia of Reagents for Organic Synthesis (e-EROS). John Wiley and Sons, Inc., 1999-2013, Eintrag für Cyanogen Azide, abgerufen am 24. Januar 2015.
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- P.G. Urben; M.J. Pitt: Bretherick's Handbook of Reactive Chemical Hazards. 8. Edition, Vol. 1, Butterworth/Heinemann 2017, ISBN 978-0-08-100971-0, S. 138.
- F. D. Marsh, M. E. Hermes: Azodicarbonitrile. In: Journal of the American Chemical Society. 87, Nr. 8, 1965, S. 1819–1820, doi:10.1021/ja01086a054, PDF.
- A. Almenningen, B. Bak, P. Jansen, T. G. Strand: Molecular structure of gaseous cyanogen azide and azodicarbonitril. In: Acta Chem. Scand. 27, Nr. 5, 1973, S. 1531–1540, doi:10.3891/acta.chem.scand.27-1531.
- Anastassiou, A.G.; Simmons, H.E.; Marsh, F.D.: Cyanonitrene. Reaction with SaturatedHydrocarbons. In: J. Am. Chem. Soc. 87 (1965) 2296–2297, doi:10.1021/ja01088a043.
- A. G. Anastassiou, H. E. Simmons: Cyanonitrene. Reaction with Saturated Hydrocarbons. In: J. Am. Chem. Soc. 89 (1967) S. 3177–3184, doi:10.1021/ja00989a018.
- M. E. Hermes, F. D. Marsh: N-Cyanoaziridines and 1-alkylalkylidenecyanamides from cyanogen azide and olefins. In: The Journal of Organic Chemistry. 37, Nr. 19, 1972, S. 2969–2979, doi:10.1021/jo00984a013.
- John E. McMurry: New ring-enlargement reaction. In: Journal of the American Chemical Society. 91, Nr. 13, 1969, S. 3676–3677, doi:10.1021/ja01041a059.
- John E. McMurry, Anthony P. Coppolino: Cyanogen azide ring-expansion reaction. In: The Journal of Organic Chemistry. 38, Nr. 16, 1973, S. 2821–2827, doi:10.1021/jo00956a019.
- F. D. Marsh, H. E. Simmons: N-Cyanoazepines from Cyanonitrene and Aromatic Compounds. In: Journal of the American Chemical Society. 87, Nr. 15, 1965, S. 3529–3530, doi:10.1021/ja01093a060.
- Joo, Y.-H.; Twamley, B.; Garg, S.; Shreeve, J.M.: Energetic Nitrogen-Rich Derivatives of 1,5-Diaminotetrazole. In: Angew. Chem. 120 (2008) S. 6332–6335, doi:10.1002/ange.200801886.