Azodicarbonitril
Azodicarbonitril ist eine thermisch instabile Kohlenstoff-Stickstoff-Verbindung mit einem Stickstoffgehalt von 70 %, die den Stoffgruppen der Azoverbindungen sowie Nitrilen zugeordnet werden kann. Azodicarbonitril tritt mit der trans- und cis-Verbindung in zwei isomeren Formen auf.
| Strukturformel | |||||||
|---|---|---|---|---|---|---|---|
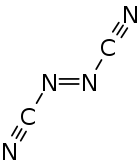 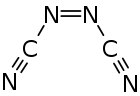 | |||||||
| trans-Form (links) und cis-Form (rechts) | |||||||
| Allgemeines | |||||||
| Name | Azodicarbonitril | ||||||
| Andere Namen |
| ||||||
| Summenformel | C2N4 | ||||||
| Kurzbeschreibung | |||||||
| Externe Identifikatoren/Datenbanken | |||||||
| |||||||
| Eigenschaften | |||||||
| Molare Masse | 80,0884 g·mol−1 | ||||||
| Aggregatzustand |
fest | ||||||
| Schmelzpunkt | |||||||
| Dampfdruck | |||||||
| Löslichkeit |
löslich in Benzol, Acetonitril, Ethylacetat, Nitromethan[1] | ||||||
| Sicherheitshinweise | |||||||
| |||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||
Darstellung und Gewinnung
Azodicarbonitril kann durch eine Gasphasenpyrolyse von Cyanazid bei 200 °C über das Cyanonitren als Intermediat und Stickstoffabspaltung hergestellt werden.[1][3]
Bei der Synthese entsteht ein Isomerengemisch.
Eine andere Synthese geht vom Cyanamid aus, welches bei −50 °C mittels Natriummethanolat in Methanol in das Natriumsalz überführt wird. Eine oxidative Umsetzung mit tert-Butylhypochlorit bei −50 °C ergibt intermediär das Natriumsalz des N-Chlorcyanamids. Beim Aufheizen erfolgt im Temperaturbereich zwischen 0 °C und 10 °C unter Abspaltung von Natriumchlorid die Bildung von Cyanonitren, welches zur Zielverbindung dimerisiert.[2]
Hier entsteht ebenfalls ein Isomerengemisch.
Eigenschaften
Azodicarbonitril ist eine kristalline, orangefarbene und flüchtige Substanz.[1] Die beobachteten Schmelzpunkte hängen von der Herstellmethode ab. Ein über Gasphasenpyrolyse hergestelltes Produkt schmilzt schon bei 35–37,5 °C.[1] Ein in Lösung aus Cyanamid gewonnenes Produkt schmilzt bei 50–55 °C.[2] Die Dampfdrücke liegen bei 0 °C etwa bei 8 mmHg, bei 10 °C bei 18 mmHg und bei 20 °C bei 40 mmHg.[3] Die Aufreinigung mittels Destillation wurde bei Temperaturen kleiner 0 °C und Drücken kleiner 1 Torr durchgeführt.[3] Azodicarbonitril kann bei mechanischer Belastung oder Erhitzen in geschlossenen Behältern detonieren.[1][5] Die Verbindung ist ohne Zersetzung in Benzol, Acetonitril, Ethylacetat, Nitromethan und 1,1,2-Trichlor-1,2,2-trifluorethan löslich. Die Lösungen in Wasser, Methanol und Diethylether sind nicht stabil.[1] Das 13C-NMR-Spektrum zeigt nur ein Signal bei 118,3 ppm.[2] Im IR-Spektrum sind die CN-Schwingung bei 2200 cm−1 und die NN-Schwingung bei 1650 cm−1 signifikant.[2] Untersuchungen mittels IR- und Raman-Spektroskopie ergaben, das die Verbindung in der trans-Form vorliegen muss.[6] Auch mit Hilfe von Gasphasenelektronenbeugungsmessungen wurde festgestellt, dass in der Gasphase im Wesentlichen das trans-Isomer vorliegt.[7] Der Bindungswinkel zwischen der Azo- und Cyanogruppe beträgt 113°. Die Cyanogruppe ist mit 172° nicht ganz linear zum Azostickstoff gebunden.[7]
Reaktionen
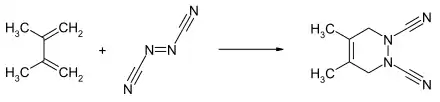
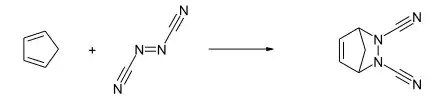
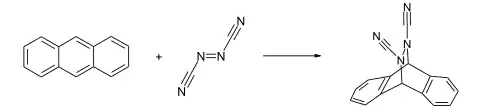
Azodicarbonitril reagiert glatt mit Dienen zu 4,5-Diazacyclohexenen.[1] Mit 2,3-Dimethylbutadien bildet sich durch eine [4+2]-Cyloaddition das 1,2-Dimethyl-4,5-dicyano-4,5-diazacyclohexen, mit Cyclopentadien das 5,6-Dicyano-5,6-diazabicyclo[2.2.1]hepten und mit Anthracen das 1,2,3,4-Tetrahydro-1,4-o-benzenophthalazin-2,3-dicarbonitril gebildet.[1]
Einzelnachweise
- F. D. Marsh, M. E. Hermes: Azodicarbonitrile. In: Journal of the American Chemical Society. 87, Nr. 8, 1965, S. 1819–1820, doi:10.1021/ja01086a054.
- Mary Gail Kinzer Hutchins, Daniel Swern: Generation of Cyanonitren: Study of the Reaction of Sodium Hydrogen Cyanamide, tert-Butyl Hypochlorite, and Terniary Amines. In: The Journal of Organic Chemistry. 47, Nr. 25, 1982, S. 4847–4850, doi:10.1021/jo00146a005.
- Børge Bak, Roar Eskildsen, Peter Jansen, Sigfrid Svensson, J. Koskikallio, Sukeji Kachi: Preparation of C2N4, Azodicarbonitrile. In: Acta Chemica Scandinavica. 25, 1971, S. 3181–3181, doi:10.3891/acta.chem.scand.25-3181 (PDF).
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- P.G. Urben; M.J. Pitt: Bretherick's Handbook of Reactive Chemical Hazards. 8. Edition, Vol. 1, Butterworth/Heinemann 2017, ISBN 978-0-08-100971-0, S. 239.
- Bak, B.; Jansen, P.: The Symmetry of Azocarbonitrile in J. Mol. Struct. 11 (1972) 25–31, doi:10.1016/0022-2860(72)85219-0.
- Almenningen, A.; Bak, B.; Jansen, P.; Strand, T.G.: Molecular Structure of Gaseous Cyanogen Azide and Azodicarbonitrile in Acta Chem. Scand. 27 (1973) 1531–1540, doi:10.3891/acta.chem.scand.27-1531, PDF.