Bromcyan
Bromcyan ist ein Derivat der Blausäure (HCN), bei dem das Wasserstoffatom durch Brom ersetzt ist. Umgangssprachlich wird es auch Bromcyanid oder Campilit genannt.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Allgemeines | |||||||||||||||||||
| Name | Bromcyan | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | BrCN | ||||||||||||||||||
| Kurzbeschreibung |
farblose, flüchtige Nadeln[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 105,9 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
61,5 °C[2] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Thermodynamische Eigenschaften | |||||||||||||||||||
| ΔHf0 |
140,5 kJ/mol[4] | ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Vorkommen
Eine Biosynthese von Bromcyan wurde in der Nitzschia cf pellucida, einer Kieselalge nachgewiesen.[5]
Darstellung und Gewinnung
Die Darstellung von Bromcyan gelingt durch die Umsetzung von Brom mit Natriumcyanid in wässriger Lösung bei Temperaturen unterhalb von 20 °C.[6][7]
Eine weitere Synthese geht vom Kaliumthiocyanat oder Ammoniumthiocyanat aus.[8]
Eigenschaften

Bromcyan ist noch um ein Vielfaches giftiger als Kaliumcyanid (KCN). Seine außerordentliche Giftwirkung beruht auf den beiden Komponenten Brom und Cyanid, die sowohl durch enzym-inhibitorische Eigenschaften als Stoffwechselgift, als auch toxisch auf Nervenzellen wirken.[2]
Bromcyan liegt in Form von leicht flüchtigen farblosen Nadeln vor. Mit einer molaren Bildungswärme von 185,6 kJ/mol für Bromcyandampf bzw. 140,4 kJ/mol für den Feststoff handelt es sich um eine instabile endotherme Verbindung,[9] Die Dampfdruckfunktion ergibt sich nach Antoine entsprechend log10(P) = A−(B/(T+C)) (P in bar, T in K) mit A = 3,53667, B = 727,385 und C = −130.052 im Temperaturbereich von 273 K bis 313 K.[9]
In Natronlauge erfolgt die Hydrolyse zu Natriumcyanat und Natriumbromid. Die Reaktion verläuft mit einer Reaktionswärme von −235 kJ·mol−1 stark exotherm.[9]
Bei höheren Temperaturen und in Gegenwart von Aluminiumbromid erfolgt eine Trimerisierung zum Cyanurbromid.[10]
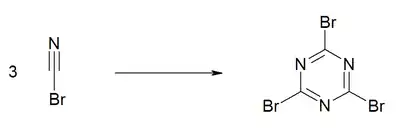
Die Trimerisierung erfolgt auch langsam bei Raumtemperatur bei der Lagerung der Verbindung über einen längeren Zeitraum.[11]
Struktur
Das BrCN-Molekül besitzt eine lineare Struktur. Die Bindungslängen der Br–C-Bindung bzw. der C–N-Bindung sind typisch für eine C–Br-Einfachbindung bzw. C–N-Dreifachbindung. Die Bindungslängen betragen für die C–Br–Bindung 1,789 Ångström, für die C–N–Bindung 1,160 Ångström.[12] Das Bromcyanmolekül ist polar. Das Dipolmoment beträgt 2,94 D.[13]
Verwendung
Bromcyan wird vorwiegend in der Goldlaugerei verwendet. In der Biochemie wird es für die Sequenzierung von Proteinen eingesetzt. Bromcyan spaltet selektiv C-terminal nach der Aminosäure Methionin. Das Methionin reagiert dabei zum Iminolacton, das anschließend säurekatalysiert zum Homoserin-Lacton hydrolysiert. Dadurch wird das Protein in kürzere Fragmente zerlegt, welche mit anderen Analysetechniken z. B. dem Edman-Abbau analysiert werden.
Sicherheitshinweise
Gasförmiges Bromcyan wird über die Haut kaum, über Atemwege und Verdauungstrakt gut resorbiert. Es kann beim Kontakt mit Wasser und Magensäure oder beim Erhitzen zu Cyanwasserstoff, Bromwasserstoff, Dicyan und Cyanurbromid hydrolysiert oder zersetzt werden. Auf Augen, Haut und Schleimhäute wirkt Bromcyan sehr stark reizend bis ätzend. Im Gegensatz zu Blausäure wird es bei Anwesenheit in der Luft ab 1 ppm als reizend wahrgenommen; bei etwa 9 ppm liegt die „Erträglichkeitsgrenze“.[2]
Einzelnachweise
- Eintrag zu Bromcyan. In: Römpp Online. Georg Thieme Verlag, abgerufen am 1. April 2014.
- Eintrag zu Bromcyan in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2018. (JavaScript erforderlich)
- Eintrag zu Cyanogen bromide in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM)
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-19.
- B. Vanelslander, C. Paul u. a.: Daily bursts of biogenic cyanogen bromide (BrCN) control biofilm formation around a marine benthic diatom. In: Proceedings of the National Academy of Sciences. 109, 2012, S. 2412, doi:10.1073/pnas.1108062109.
- K.H. Slotta: Bromcyan und wasser-freie Blausäure in Chem. Ber. 67 (1934) 1028-1030. doi:10.1002/cber.19340670622.
- Hartmann, W.W., Dreger, E.E.: Cyanogen Bromide In: Organic Syntheses. 11, 1931, S. 30, doi:10.15227/orgsyn.011.0030; Coll. Vol. 2, 1943, S. 150 (PDF).
- W. König: Untersuchungen aus dem organ.‐chem. Laboratorium der Technischen Hochschule zu Dresden. XCVII. Über die Umsetzung von Rhodaniden mit Brom in wäßriger Lösung. In: Journal für Praktische Chemie. Band 84, Nr. 1, September 1911, S. 558–560, doi:10.1002/prac.19110840139.
- G. Lord, A. A. Woolf: The cyanogen halides. Part III. Their heats of formation and free energies. In: Journal of the Chemical Society (Resumed). 1954, S. 2546–2551, doi:10.1039/JR9540002546.
- F. Oberhauser: Das Verhalten des Bromcyans gegenüber Metallsalzen in Chem. Ber. 60 (1927) 1434–1439 doi:10.1002/cber.19270600628.
- M.I. Grossmann: Cyanogen bromide danger in Chem. Eng. News 58 (1980) 43.
- A. G. Smith, H. Ring, W. V. Smith, W. Gordy: Interatomic Distances and Nuclear Quadrupole Couplings in ClCN, BrCN, and ICN in Phys. Rev. 74 (1948) 370–372. doi:10.1103/PhysRev.74.370.
- J. K. Tyler, J. Sheridan: Structural studies of linear molecules by microwave spectroscopy in Trans. Faraday Soc. 59 (1963) 2661–2670. doi:10.1039/TF9635902661.


