5-Azido-1H-tetrazol
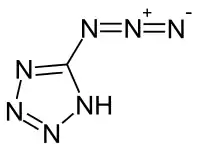
5-Azido-1H-tetrazol ist eine heterocyclische, hochexplosive chemische Verbindung, die zu den Gruppen der organischen Tetrazole und Azide zählt. Mit einem Stickstoffgehalt von 88,3 % ist die Verbindung das derzeit stickstoffreichste, synthetisierte Tetrazolderivat.[1]
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||
| Allgemeines | |||||||||||||
| Name | 5-Azido-1H-tetrazol | ||||||||||||
| Andere Namen |
| ||||||||||||
| Summenformel | CHN7 | ||||||||||||
| Kurzbeschreibung |
farblose Kristalle[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 111,7 g·mol−1 | ||||||||||||
| Aggregatzustand |
fest | ||||||||||||
| Dichte |
1,72 g·cm−3[1] | ||||||||||||
| Schmelzpunkt | |||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Geschichte
Eine erste Synthese, wenn auch mit schlechter Ausbeute, wurde von J. Thiele und H. Ingle schon 1895 beschrieben. Dabei wurde Tetrazylhydrazid mit Natriumnitrit und Salzsäure umgesetzt. Das erhaltene Produkt wurde als Tetrazylazoimid bzw. Diazotetrazolimid bezeichnet, wobei die Azidstruktur nicht erkannt wurde.[3] 5-Azido-1H-tetrazol wurde dann erst wieder 1937 in einer Patentschrift von W. Friederich und K. Flick beschrieben.[4]
Gewinnung und Darstellung
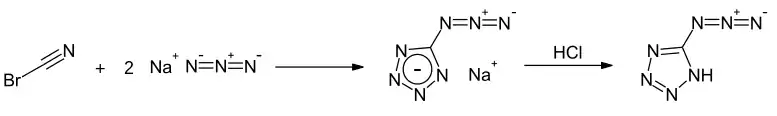
Die Synthese von 5-Azido-1H-tetrazol erfolgt durch die Umsetzung von Bromcyan mit Natriumazid, wobei zunächst das Cyanamid als Intermediat gebildet wird, welches sich weiter zum Natriumsalz des 5-Azido-1H-tetrazols umsetzt. Die Zielverbindung resultiert dann durch eine anschließende Behandlung mit Salzsäure.[5]
Eine weitere Synthese geht vom 5-Amino-1H-tetrazol aus, welches zunächst mittels Natriumnitrit und Salzsäure in die entsprechende Diazoniumverbindung überführt wird. Die anschließende Umsetzung mit Natriumazid ergibt die Zielverbindung.[6][7][8]
Eigenschaften
Physikalische Eigenschaften
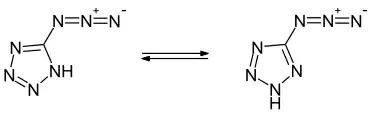
5-Azido-1H-tetrazol bildet farblose, nadelförmige Kristalle, die bei 75 °C schmelzen.[1] Die Verbindung kristallisiert in einem monoklinen Kristallgitter in der Raumgruppe P21/c (Raumgruppen-Nr. 14).[1] Mit einer Bildungsenthalpie von 611 kJ·mol−1 handelt es sich um eine stark endotherme Verbindung.[1] Als tautomeres Isomer kann das 5-Azido-2H-tetrazol formuliert werden. Quantenchemische Berechnungen zeigen, dass dieses in der Gasphase das stabilere Tautomer wäre. Im Kristallgitter bzw. in Lösung wird allerdings das 1H-Tautomer auf Grund von Wasserstoffbrückenbindungen stabilisiert.[1]
Chemische Eigenschaften
Die Verbindung ist thermisch instabil und kann sich explosionsartig zersetzen. In einer DSC-Messung wird ab 165 °C eine stark exotherme Zersetzung beobachtet.[1] Sie ist extrem empfindlich gegenüber Schlag und Reibung. Die Schlagempfindlichkeit wird mit < 1 J, die Reibempfindlichkeit mit < 5 N angegeben.[1]
Verwendung
Wegen der geringen Stabilität und hohen Empfindlichkeit zur spontanen Explosion konnte sich keine kommerzielle Anwendung durchsetzen.[1]
Literatur
- Robert Matyas, Jiri Pachman: Primary Explosives. Springer, 2013, ISBN 978-3-642-28435-9, S. 209–212.
Einzelnachweise
- Jörg Stierstorfer, Thomas M. Klapötke, Anton Hammerl, Robert D. Chapman: 5-Azido-1H-tetrazole – Improved Synthesis, Crystal Structure and Sensitivity Data. In: Zeitschrift für anorganische und allgemeine Chemie. Band 634, Nr. 6–7, 2008, S. 1051–1057, doi:10.1002/zaac.200800003.
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Johannes Thiele, Harry Ingle: Ueber einige Derivate des Tetrazols. In: Justus Liebigs Annalen der Chemie. Band 287, Nr. 3, 1895, S. 233–265, doi:10.1002/jlac.18952870302.
- Patent DE719135: Verfahren zur Herstellung von Tetrazylazid bzw. seinen Salzen. Angemeldet am 14. September 1937, veröffentlicht am 5. März 1942, Erfinder: W. Friederich, K. Flick.
- F. D. Marsh: Cyanogen azide. In: The Journal of Organic Chemistry. Band 37, Nr. 19, 1972, S. 2966–2969, doi:10.1021/jo00984a012.
- Anton Hammerl, Thomas M. Klapötke, Peter Mayer, Jan J. Weigand, Gerhard Holl: Synthesis, Structure, Molecular Orbital Calculations and Decomposition Mechanism for Tetrazolylazide CHN7, its Phenyl Derivative PhCN7 and Tetrazolylpentazole CHN9. In: Propellants, Explosives, Pyrotechnics. Band 30, Nr. 1, 2005, S. 17–26, doi:10.1002/prep.200400081.
- Anton Hammerl, Thomas M. Klapötke, Heinrich Nöth, Markus Warchhold, Gerhard Holl: Synthesis, Structure, Molecular Orbital and Valence Bond Calculations for Tetrazole Azide, CHN7. In: Propellants, Explosives, Pyrotechnics. Band 28, Nr. 4, 2003, S. 165–173, doi:10.1002/prep.200300001.
- Anton Hammerl, Thomas M. Klapötke: Tetrazolylpentazoles:Nitrogen-Rich Compounds. In: Inorganic Chemistry. Band 41, Nr. 4, 2002, S. 906–912, doi:10.1021/ic0108134.