1,5-Diamino-1H-tetrazol
1,5-Diamino-1H-tetrazol ist eine heterocyclische, hochexplosive Verbindung, die zu der Stoffgruppe der organischen Tetrazole zählt. Mit einem Stickstoffgehalt von 83,97 % ist die Verbindung ein an Stickstoff reiches Tetrazolderivat.[5]
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
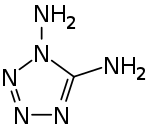 | |||||||||||||
| Allgemeines | |||||||||||||
| Name | 1,5-Diamino-1H-tetrazol | ||||||||||||
| Andere Namen |
| ||||||||||||
| Summenformel | CH4N6 | ||||||||||||
| Kurzbeschreibung |
farblose Kristalle[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 100,083 g·mol−1 | ||||||||||||
| Aggregatzustand |
fest | ||||||||||||
| Dichte |
1,571 g·cm−3 (19,85 °C)[2] | ||||||||||||
| Schmelzpunkt | |||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Geschichte
Die Herstellung der Substanz durch Umsetzung von Thiocarbazid mit Natriumazid und Blei(II)-oxid wurde erstmals 1931 von R. Stolle beschrieben.[6] Im Jahr 1969 beschrieb R. Rapp eine Aminierungsreaktion von 5-Aminotetrazol mittels Hydroxylamin-O-sulfonsäure, wobei ein Gemisch aus 1,5-Diaminotetrazol und 2,5-Diaminotetrazol und nur 8,5 % Ausbeute an der Zielverbindung erhalten wurde.[7]
Darstellung und Gewinnung
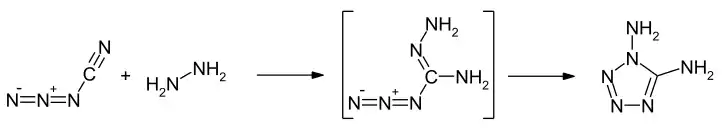
Die Synthese von 1,5-Diamino-1H-tetrazol kann durch die Reaktion von Aminoguanidiniumchlorid mit salpetriger Säure erfolgen, wobei ein Azidoguanylchlorid als Zwischenprodukt auftritt.[8] Die Verbindung kann auch durch die Umsetzung von Cyanazid mit Hydrazin erhalten werden.[5] Hier entsteht intermediäre ein Azidohydrazon, welches dann unter Ringschluss die Zielverbindung ergibt.
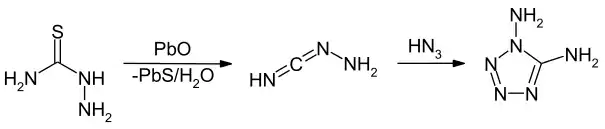
Eine weitere Synthese geht vom Thiosemicarbazid aus, welches einfach aus Kaliumthiocyanat und Hydrazin in saurem Medium gewonnen werden kann. Im ersten Schritt wird durch die Umsetzung mit Bleioxid die Zwischenverbindung 1-Hydrazinylenmethanimin erhalten. Diese ergibt durch Umsetzung mit Stickstoffwasserstoffsäure unter Ringschluss das 1,5-Diamino-1H-tetrazol.[9]
Eigenschaften
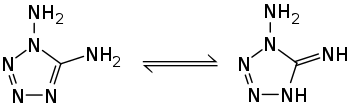
1,5-Diamino-1H-tetrazol ist ein kristaller Feststoff, der bei 187–190 °C schmilzt.[3][1] Oberhalb des Schmelzpunktes wird eine stark exotherme Zersetzung mit einer Zersetzungswärme von −850 kJ·mol−1 beobachtet.[10] Die Verbindung kristallisiert in einem monoklinen Kristallgitter mit der Raumgruppe P21/c (Raumgruppen-Nr. 14).[2] Die Verbindung kann in zwei tautomeren Strukturen auftreten.[2][11]
Als basische Verbindung werden mit Säuren Salze gebildet. So bildet sich mit Salzsäure das 1,5-Diamino-1H-tetrazoliumchlorid (CH4N6·HCl, CAS-Nr. 23685-20-3).
Verwendung
Die Verbindung dient zur Herstellung weiterer hochenergetischer Salze. Beispiele dafür sind:
- 1,5-Diamino-1H-tetrazoliumnitrat (CH4N6·HNO3, CAS-Nr. 95335-56-1)
- 1,5-Diamino-1H-tetrazoliumpikrat (CH4N6·C6H3N3O7, CAS-Nr. 95335-57-2)
- 1,5-Diamino-1H-tetrazoliumperchlorat (CH4N6·HClO4)
Über das Perchlorat kann mit Kaliumdinitramid das Dinitramidsalz erhalten werden.[9]
Einzelnachweise
- Tao, G.-H.; Guo, Y.; Parrish, D.A.; Shreeve, J.M.: Energetic 1,5-diamino-4H-tetrazolium nitro-substituted azolates in J. Mat. Chem. 20 (2010) 2999–3005, doi:10.1039/B925267C.
- Lyakhov, A.S.; Gaponik, P.N.; Voitekhovich, S.V.: 1,5-Diamino-1H-1,2,3,4-tetrazole in Acta Cryst. C, Cryst. Struct. Comm. 57 (2001) 185–186, doi:10.1107/S010827010001622X.
- Raap, R.: Amination of tetrazoles with hydroxylamine-O-sulfonic acid: 1- and 2-aminotetrazoles. In: Canadian Journal of Chemistry. 47, 1969, S. 3677–3681, doi:10.1139/v69-606.
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Joo, Y.-H.; Twamley, B.; Garg, S.; Shreeve, J.M.: Energetic Nitrogen-Rich Derivatives of 1,5-Diaminotetrazole in Angew. Chem. 120 (2008) 6332–6335, doi:10.1002/ange.200801886.
- Stolle, R.; Gaertner, E.: Über Amino-1-amino-5-tetrazole und Amino-1-hydrazino-5-tetrazol in J. prakt. Chem. 132 (1931) 209–226, doi:10.1002/prac.19311320115.
- Rapp, R.: Amination of tetrazoles with hydroxylamine-0-sulfonic acid: 1- and 2-aminotetrazoles in Can. J. Chem. 47 (1969) 3677–3681, doi:10.1139/v69-606, pdf.
- Galvez-Ruiz, J.C.; Holl, G.; Karaghiosoff, K.; Klapötke, T.M.; Loehnwitz, K.; Mayer, P.; Noeth, H.; Polborn, K.; Rohbogner, C.J.; Suter, M.; Weigand, J.J.: Derivatives of 1,5-Diamino-1H-tetrazole: A New Family of Energetic Heterocyclic-Based Salts in Inorg. Chem. 44 (2005) 4237–4253, doi:10.1021/ic050104g.
- Klapötke, T.M.: Chemistry of High-Energy Materials, 2nd Edition, 2012 Walter de Gruyter GmbH & Co. KG, Berlin/Boston, ISBN 978-3-11-027358-8, S. 161–163, (abgerufen über De Gruyter Online).
- Lesnikovich, A.I.; Ivashkevich, O.A.; Levchik, S.V.; Balabanovich, A.I.; Gaponik, P.N.; Kulak, A.A.: Thermal decomposition of aminotetrazoles in Thermochim. Acta 388 (2002) 233–251, doi:10.1016/S0040-6031(02)00027-8.
- Levchik, S.V.; Balabanovich, A.I.; Ivashkevich, O.A.; Lesnikovich, A.I.; Gaponik, P.N.; Costa, L.: The thermal decomposition of aminotetrazoles. Part 2. 1-methyl-5-aminotetrazole and 1,5-diaminotetrazole in Thermochim. Acta 225 (1993) 53–65, doi:10.1016/0040-6031(93)85082-K.