Thallium(I)-hydroxid
Thallium(I)-hydroxid ist eine anorganische chemische Verbindung des Thalliums aus der Gruppe der Hydroxide.
| Kristallstruktur | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
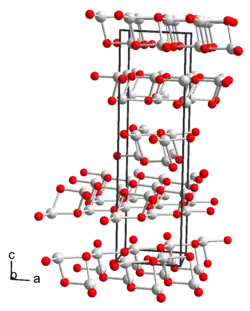 | ||||||||||||||||
| _ Tl+ _ OH− | ||||||||||||||||
| Kristallsystem |
monoklin | |||||||||||||||
| Raumgruppe |
C2 (Nr. 5) | |||||||||||||||
| Gitterparameter |
a = 594,9 pm, b = 622,0 pm, c = 2123,2 pm, β = 91,590° | |||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Thallium(I)-hydroxid | |||||||||||||||
| Andere Namen |
Thalliumhydroxid | |||||||||||||||
| Verhältnisformel | Tl(OH) | |||||||||||||||
| Kurzbeschreibung |
gelber Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 221,39 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||
| Dichte |
7,44 g·cm−3[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit |
löslich in Wasser und Ethanol[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||
| ΔHf0 |
−239 kJ·mol−1 [4] | |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Gewinnung und Darstellung
Thallium(I)-hydroxid scheidet sich bei der Zersetzung von Thalliumethylalkoholat durch Wasser aus.[1]
Dies kann auch durch direkte Reaktion von Thallium mit Ethanol und Sauerstoff geschehen.[1]
Thallium(I)-hydroxid kann auch durch Reaktion von Thallium(I)-sulfat mit Bariumhydroxid gewonnen werden.[1]
Eigenschaften
Thallium(I)-hydroxid ist ein farbloser[5] bis gelber Feststoff, der in Form von Nadeln vorliegt, die sich leicht dunkel färben und löslich in Wasser und Ethanol sind. Gesättigte wässrige Lösungen der Verbindung greifen Glas besonders in der Hitze an. Thallium(I)-hydroxid und seine stark basischen wässrige Lösungen[5] nehmen unter Bildung von Thallium(I)-carbonat begierig Kohlendioxid auf.[1] Bei Temperaturen von etwa 140 °C zersetzt sich die Verbindung unter Bildung von Thallium(I)-oxid.[5] Mit Sauerstoff reagiert die Verbindung zu Thallium(III)-oxid.[6] Thallium(I)-hydroxid hat eine monokline Kristallstruktur mit der Raumgruppe C2 (Raumgruppen-Nr. 5) und den Gitterparametern a = 594,9 pm, b = 622,0 pm, c = 2123,2 pm, β = 91,590°.[7]
Verwendung
Thallium(I)-hydroxid kann in der organischen Chemie für Suzuki-Kupplungen verwendet werden.[8] Sie kann auch zur Detektion von Ozon verwendet werden, da sich mit einer wässrigen Lösung der Verbindung getränktes Papier bei Anwesenheit von Spuren von Ozon braun färbt.[6]
Einzelnachweise
- Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band I, Ferdinand Enke, Stuttgart 1975, ISBN 3-432-02328-6, S. 883.
- William M. Haynes: CRC Handbook of Chemistry and Physics, 93rd Edition. CRC Press, 2012, ISBN 1-4398-8049-2, S. 4–94 (eingeschränkte Vorschau in der Google-Buchsuche).
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- A. F. Holleman, N. Wiberg: Anorganische Chemie. 103. Auflage. 1. Band: Grundlagen und Hauptgruppenelemente. Walter de Gruyter, Berlin / Boston 2016, ISBN 978-3-11-049585-0, S. 1398 (Leseprobe: Teil A – Grundlagen der Chemie Der Wasserstoff. Google-Buchsuche).
- Mary Eagleson: Concise Encyclopedia Chemistry. Walter de Gruyter, 1994, ISBN 3-11-085403-1, S. 1088 (eingeschränkte Vorschau in der Google-Buchsuche).
- Ronald Rich: Inorganic Reactions in Water. Springer, 2007, ISBN 3-540-73962-9, S. 321 (eingeschränkte Vorschau in der Google-Buchsuche).
- Oleg I. Siidra, Sergey N. Britvin, Sergey V. Krivovichev, Wulf Depmeier: Polytypism of Layered Alkaline Hydroxides: Crystal Structure of TlOH. In: Zeitschrift für anorganische und allgemeine Chemie. 636, 2010, S. 595–599, doi:10.1002/zaac.200900367.
- Hisashi Yamamoto, Koichiro Oshima: Main Group Metals in Organic Synthesis. John Wiley & Sons, 2006, ISBN 978-3-527-60535-4, S. 404 (eingeschränkte Vorschau in der Google-Buchsuche).