Galantamin
Galantamin (auch Galanthamin von galanthus) ist eine natürlich vorkommende Substanz aus der Gruppe der Amaryllidaceen-Alkaloide.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
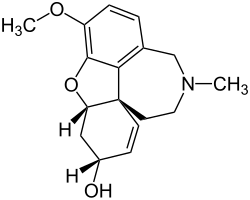 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Galantamin | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel |
| |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code |
N06DA04 | |||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 287,35 g·mol−1 | |||||||||||||||||||||
| Schmelzpunkt |
| |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Vorkommen

Galantamin kann aus dem Kleinen Schneeglöckchen (Galanthus nivalis), dem Kaukasischen Schneeglöckchen (Galanthus woronowii) sowie einigen Narzissenarten wie der Gelben Narzisse (Osterglocke) gewonnen werden. Erstmals isoliert wurde er 1953 aus den Zwiebeln des Kaukasischen Schneeglöckchens. Heute kann der Wirkstoff auch synthetisch hergestellt werden.
Synthese
Biogenese
Die Biosynthese erfolgt ausgehend von zwei Aminosäuren: L-Tyrosin geht in Tyramin über und aus L-Phenylalanin wird über Zimtsäure, p-Cumarsäure und Kaffeesäure Protocatechualdehyd gebildet. Letzterer reagiert mit Tyramin zu einer Schiff'schen Base, die zu Norbelladin hydriert wird. Die Ausbildung der weiteren Ringe erfolgt durch oxidative Kupplung und führt zum (–)-Galantamin.[3]
Technische Synthese
Die industrielle Galantamin-Synthese wurde von der österreichischen Firma Sanochemia Pharmazeutika entwickelt.[4] Sie beruht auf einem 1999 veröffentlichten neunstufigen Verfahren.[5] Besondere Schritte sind eine oxidative Phenolkupplung und eine durch Kristallisation induzierte chirale Umwandlung von (±)-Narwedin zu (–)-Narwedin. Im letzten Schritt wird die Ketogruppe des (–)-Narwedins diastereoselektiv mittels L-Selektrid zum Alkohol reduziert, es entsteht (−)-Galantamin.[5][6]
Eigenschaften
Galantamin hat drei chirale Zentren. Die natürlich vorkommende Variante ist das (–)-Galantamin. Das Enantiomer (+)-Galantamin[7] (ent-Galantamin) kann in der aus chemischer Synthese stammenden Substanz als Verunreinigung auftreten.[8] Als C-6-Epimer ist das (4aS,6S,8aS)-Galantamin[9] (epi-Galantamin) beschrieben. Mit dem Galantamin strukturell verwandte Alkaloide sind Narwedin und Lycoramin (1,2-Dihydrogalantamin).
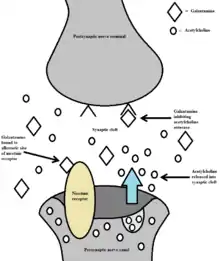
Galantamin gehört pharmakologisch zur Gruppe der Acetylcholinesterasehemmer. Durch die Hemmung der Acetylcholinesterase sowie durch Modulation von nikotinergen Acetylcholin-Rezeptoren (dualer Wirkmechanismus) führt der Wirkstoff zu einer Erhöhung der Acetylcholinkonzentration im synaptischen Spalt.[10] Ferner wird ihm eine starke, mit Morphin vergleichbare, analgetische Wirkung zugeschrieben.[11]
Medizinische Verwendung
Anwendungsgebiete
Das Alkaloid wird heute vorwiegend als Antidementivum zur Behandlung von Demenzen, insbesondere Alzheimer (hierbei entsteht ein Mangel an Acetylcholin, kurz ACh, einem Neurotransmitter) eingesetzt. Anfangs setzte man den Wirkstoff unter anderem zur Aufhebung der durch Curare-Verbindungen ausgelösten Muskelentspannungen bei Operationen ein. Noch heute nutzt man es wegen seines kompetetiven Antagonismus im Falle einer Organophosphat-, Soman-, Sarin-, VX- und Tabun-Vergiftung.[12]
Wegen seiner vagotonen (parasympathikomimetischen), kardioprotektiven und antiinflammatorischen (entzündungshemmenden) Eigenschaften kann Galantamin u. a. auch zur Behandlung von Herz-Kreislauf-Erkrankungen genutzt werden (Off-Label-Use).[13][14]
Nutzenbewertung durch IQWIG
Bereits 2007 hatte das Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) eine Nutzenbewertung der zur Gruppe der Cholinesterasehemmer gehörenden Wirkstoffe Donepezil, Galantamin und Rivastigmin bei der Behandlung von Alzheimer vorgelegt. Zu Galantamin gibt es inzwischen weitere, zum Teil unveröffentlichte, Studiendaten, die den Gemeinsamen Bundesausschuss (G-BA) veranlasste, das IQWiG den Nutzen von Galantamin erneut untersuchen zu lassen. Dabei kam der Ausschuss zu dem Ergebnis, dass Galantamin zwar bei Patientinnen mit leichter bis mittelschwerer Alzheimer-Demenz – zumindest bei einer höheren Dosis – die Denk- und Merkfähigkeit positiv beeinflussen kann, jedoch bei gesunden kein Nutzen belegt ist.[15][16]
Nebenwirkungen
Patienten, die Galantamin einnahmen, litten häufiger unter Übelkeit oder Erbrechen als diejenigen, die ein Placebo erhielten. Zudem brachen sie die Studie häufiger wegen unerwünschter Nebenwirkungen ab.[15] Am 22. September 2015 informierte der Hersteller Janssen-Cilag über einen zusätzlichen Warnhinweis für Reminyl. Demzufolge kann es unter einer Behandlung mit Galantaminhydrobromid zu schwerwiegenden Hautreaktionen (Stevens-Johnson-Syndrom, akute generalisierte exanthemische Pustulose (AGEP)) kommen. Patienten, die mit Galantaminhydrobromid behandelt werden, sollten über die entsprechenden Symptome informiert und die Therapie beim ersten Auftreten eines Hautausschlags beendet werden.
Handelsnamen
Galantamin kam in Deutschland im März 2001 als Reminyl (Janssen Pharmaceutica) auf den Markt,[17] als solches ist es ferner auch in Österreich und der Schweiz auf dem Markt. Seit Oktober 2011 ist das erste generische Galantamin mit dem Markennamen Galnora (TAD Pharma GmbH) im Handel. Weitere Präparate sind etwa Galafix (A), Galafont (A), Galamil (A), Galatifer (A) und weitere Generika.
Einzelnachweise
- The Merck Index. An Encyclopaedia of Chemicals, Drugs and Biologicals. 14. Auflage, 2006, S. 746, ISBN 978-0-911910-00-1.
- Datenblatt Galantamine hydrobromide from Lycoris sp. bei Sigma-Aldrich, abgerufen am 18. April 2021 (PDF).
- E. Teuscher: Biogene Arzneimittel. 5. Auflage, Wissenschaftliche Verlagsgesellschaft, 1997, S. 331 f. ISBN 3-8047-1482-X.
- Werner Sommer: Pharmaunternehmen und TU-Chemiker synthetisierten Wirkstoff für Alzheimer-Medikament. TU Wien, 27. November 2000, abgerufen am 26. September 2008.
- Bernhard Küenburg, Laszlo Czollner, Johannes Fröhlich,Ulrich Jordis: Development of a Pilot Scale Process for the Anti-Alzheimer Drug (−)-Galantamine Using Large-Scale Phenolic Oxidative Coupling and Crystallisation-Induced Chiral Conversion. In: Organic Process Research & Development. Band 3(6), 1999, S. 425–431, doi:10.1021/op990019q.
- A. Kleemann, J. Engel, B. Kutscher, D. Reichert: Pharmaceutical Substances. Galantamine (GP-37267). Hrsg.: Georg Thieme Verlag. 5. Auflage, 2009.
- Externe Identifikatoren von bzw. Datenbank-Links zu (+)-Galantamin: CAS-Nummer: 60384-53-4, PubChem: 906210, ChemSpider: 792444, Wikidata: Q27270692.
- Monografie „Galantaminhydrobromid“. Europäisches Arzneibuch. 8. Ausgabe, Grundwerk 2014, S. 3442 f.
- Externe Identifikatoren von bzw. Datenbank-Links zu epi-Galantamin: CAS-Nummer: 1668-85-5, EG-Nummer: 684-870-2, ECHA-InfoCard: 100.210.311, PubChem: 676392, ChemSpider: 589108, Wikidata: Q27286219.
- G. Geisslinger et al.: Mutschler Arzneimittelwirkungen. 11. Auflage. WVG, Stuttgart 2019, S. 343.
- RÖMPP Lexikon Chemie. Band 2: Cm - G. 10. Auflage, 1996-1999. S. 1449.
- E. X. Albuquerque, E. F. R. Pereira, Y. Aracava, W. P. Fawcett, M. Oliveira, W. R. Randall, M. Adler: Effective countermeasure against poisoning by organophosphorus insecticides and nerve agents. In: Proceedings of the National Academy of Sciences. 103, Nr. 35, 2006, S. 13220–13225. doi:10.1073/pnas.0605370103.
- Peter Nordström, Dorota Religa, Anders Wimo, Bengt Winblad, Maria Eriksdotter: The use of cholinesterase inhibitors and the risk of myocardial infarction and death: a nationwide cohort study in subjects with Alzheimer's disease. In: European Heart Journal. Band 34, Nr. 33, 1. September 2013, S. 2585–2591, doi:10.1093/eurheartj/eht182 (oup.com).
- C.-J. Estler (Hrsg.): Pharmakologie und Toxikologie. 4. Aufl. Schattauer, Stuttgart u. New York 1995. ISBN 3-7945-1645-1. S. 41–46.
- Galantamin und Rivastigmin-Pflaster: Positiver Einfluss auf Kognition möglich PM des IQWiG (2. April 2012).
- Cholinesterasehemmer bei Alzheimer-Demenz – Ergänzungsauftrag: Rivastigmin Pflaster und Galantamin Abschlussbericht des IQWiG (abgerufen am 2. April 2012).
- Neu auf dem Markt - Galantamin (REMINYL) gegen Alzheimer, arznei-telegramm, 2001.