2-Ethyl-2-oxazolin
2-Ethyl-2-oxazolin (EtOx) ist ein 2-Oxazolin-Derivat und ein cyclischer Imidsäureester. Die Verbindung findet Verwendung insbesondere als Monomer zur kationischen ringöffnenden Polymerisation zu Poly(2-alkyloxazoline)n[8], die als gut wasserlösliche und biokompatible Materialien für biomedizinische Anwendungen untersucht werden.[9]
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | 2-Ethyl-2-oxazolin | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C5H9NO | |||||||||||||||
| Kurzbeschreibung |
farblose bis schwach gelbe Flüssigkeit[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 99,13 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||
| Dichte | ||||||||||||||||
| Schmelzpunkt |
−62 °C[2] | |||||||||||||||
| Siedepunkt | ||||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit |
| |||||||||||||||
| Brechungsindex | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Herstellung
Aus Propionsäure und -derivaten
Aus Carbonsäuren, Carbonsäureestern, Carbonsäureamiden und Nitrilen sind mit 2-Aminoalkoholen durch Erhitzen auf 200 °C unter Dehydratisierung die entsprechenden N-(2-Hydroxyalkyl)carbamide zugänglich, die bei weiterem Erhitzen auf 260–280 °C unter erneuter Wasserabspaltung in 2-Alkyl-2-oxazoline übergehen.

So wird aus Propionsäure und Monoethanolamin (MEA) zunächst N-(2-Hydroxyethyl)propionamid in 74%iger Ausbeute gebildet, das in ca. 75%iger Ausbeute zu 2-Ethyl-2-oxazolin dehydratisiert werden kann.[3]
propionamid.svg.png.webp)
Weniger drastische Reaktionsbedingungen erfordert die Dehydratisierung des N-(2-Hydroxyethyl)propionamids im Vakuum in Gegenwart von Eisen(III)-chlorid, das Produkt in 90%iger Ausbeute liefert.[10]
Noch höhere Ausbeuten von 96,2 % werden durch Erhitzen mit Zinkacetat-Dihydrat erzielt.[11]
Eine als Eintopfreaktion ökonomische Route ist das Erhitzen des Salzes der Propionsäure mit Ethanolamin auf 200 °C im Vakuum in Gegenwart von Zinkchlorid-dihydrat, die 2-Ethyl-2-oxazolin in einer Ausbeute von 82 % liefert.[11] Reines 2-Ethyl-2-oxazolin kann aus dem wasserhaltigen Destillat durch Extraktion mit Diethylbenzol und anschließende Destillation[11] isoliert bzw. durch Destillation mit Diethylphosphit oder Dimethyldichlorsilan gereinigt und bis auf einen Restwassergehalt von 10 ppm getrocknet werden.[12]
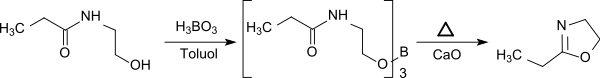
Eine weitere Eintopfreaktion ist die dreistufige Umsetzung von Propionsäure mit 2-Aminoethanol zum 2-Hydroxyethylamid, das mit Borsäure bei 130 °C zum Borsäureester reagiert, der bei 280 °C in 92%iger Ausbeute zum 2-Ethyl-2-oxazolin thermolysiert wird.[13]
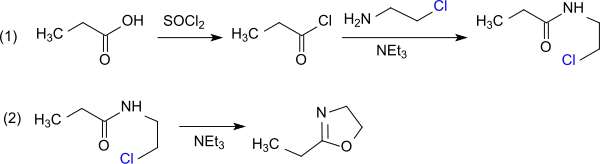
Das aus Propionsäure und Thionylchlorid erhaltene Propionylchlorid bildet mit MEA in Gegenwart von z. B. Pyridin als Säurefänger N-Propionyl-2-aminoethanol, das mit weiterem Thionylchlorid unter Bildung des 2-Chlorethylamids reagiert. Mit dem Chloridion als besserer Abgangsgruppe wird diese Zwischenstufe durch Erhitzen einfacher zum Oxazolin cyclisiert. Wegen der Neigung von Oxazolinen zur Ringöffnung durch Chloridionen bei Protonierung des Imin-Stickstoffs muss unter Wasserausschluss gearbeitet werden.[14]

Die direkte Umsetzung von Propanoylchlorid mit 2-Chlorethylamin-hydrochlorid in Gegenwart von Triethylamin vermeidet die Entstehung von Wasser.
Aus Propionaldehyd
Propionaldehyd reagiert mit 2-Aminoethanol in tert-Butanol in Gegenwart des Iodierungsreagenzes 1,3-Diiod-5,5-dimethylhydantoin (DIH) und Kaliumcarbonat zu 2-Ethyl-2-oxazolin.[15]

Eigenschaften
2-Ethyl-2-oxazolin ist eine gut wasserlösliche, aminartig riechende,[5] farblose Flüssigkeit, die auch in einer Vielzahl von organischen Lösungsmitteln löslich ist. Wässrige Lösungen reagieren alkalisch. Die Verbindung ist im Alkalischen stabil und hydrolysiert unter Säureeinwirkung.
Anwendungen
In wasserfreier Form findet 2-Ethyl-2-oxazolin im Wesentlichen Anwendung als Monomer.[8]
Die kationische ringöffnende Polymerisation von 2-Ethyl-2-oxazolin[7] wird durch Alkylierung mit z. B. Methyltosylat oder Triflaten (insbesondere Methyltriflat) initiiert und führt zu dem wasserlöslichen Poly(2-ethyl-2-oxazolin), das ein N-propionylsubstituiertes lineares Polyethylenimin darstellt und auch als Pseudo-Polypeptid aufgefasst werden kann.[16]
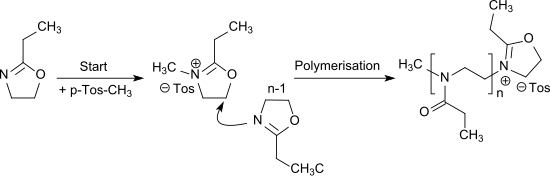
Die Polymerisation von EOx kann auch als lebende kationische Polymerisation ausgeführt werden.[17]
Copolymere mit anderen 2-Alkyl-2-oxazolinen[18] und anderen Monomeren[19] erlauben die Darstellung von statistischen Copolymeren und Blockcopolymeren.
Die erhaltenen Copolymeren können als biokompatible Wirkstoffträger[20] (engl. drug carrier), in Beschichtungen und Klebstoffen sowie in vielen anderen Anwendungen[6] eingesetzt werden.
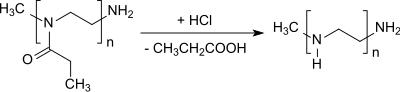
Die Abspaltung der Propionylgruppe von Poly(2-ethyl-2-oxazolin) liefert lineares Polyethylenimin.[21][22]
Einzelnachweise
- Eintrag zu 2-Ethyl-2-oxazoline bei TCI Europe, abgerufen am 5. Juni 2016.
- Datenblatt 2-Ethyl-2-oxazolin bei Sigma-Aldrich, abgerufen am 23. Oktober 2021 (PDF).
- H. Wenker: The synthesis of Δ2-oxazolines and Δ2-thiazolines from N-acyl-2-aminoethanols. In: J. Amer. Chem. Soc. Band 57, Nr. 6, 1935, S. 1079–1080, doi:10.1021/ja01309a034.
- H. Witte, W. Seeliger: Cyclische Imidsäureester aus Nitrilen und Aminoalkoholen. In: Justus Liebigs Ann. Chem. Band 6, 1974, S. 996–1009, doi:10.1002/jlac.197419740615.
- Datenblatt 2-Ethyl-2-oxazoline bei AlfaAesar, abgerufen am 5. Juni 2016 (PDF) (JavaScript erforderlich).
- Etox, 2-Ethyl-2-Oxazoline, Product Information Sheet. Polymer Chemistry Innovations, Inc., abgerufen am 19. Juli 2016 (englisch).
- B.L. Rivas, S.I. Ananias: Ring-opening polymerization of 2-ethyl-2-oxazoline. In: Polym. Bull. Band 18, Nr. 3, 1987, S. 189–194, doi:10.1007/BF00255109.
- T. Kagiya, S. Narisawa, T. Maeda, K. Fukui: Ring-opening polymerization of 2-substituted 2-oxazolines. In: J. Polym. Chem., Polym. Lett. Band 4, Nr. 7, 2003, S. 441–445, doi:10.1002/pol.1966.110040701.
- R. Hoogenboom: Poly(2-oxazoline)s: A polymer class with numerous potential applications. In: Angew. Chem. Int. Ed. Band 48, Nr. 43, 2009, S. 7978–7994, doi:10.1002/anie.200901607.
- Patent US4203900: Process for preparing 2-oxazolines. Angemeldet am 3. Januar 1977, veröffentlicht am 20. Mai 1980, Anmelder: The Dow Chemical Co., Erfinder: M.E. Kaiser.
- Patent US4354029: Preparation of 2-substituted 2-oxazolines with organic zinc salt catalysts. Angemeldet am 30. November 1981, veröffentlicht am 12. Oktober 1982, Anmelder: The Dow Chemical Co., Erfinder: M.E. Kaiser, D.L. Larson.
- Patent US4281137: Purification of 2-oxazolines. Angemeldet am 20. Februar 1980, veröffentlicht am 28. Juli 1981, Anmelder: The Dow Chemical Co., Erfinder: J.W. Sanner, P.W. Owen.
- B. Ilkgul, D. Gunes, O. Sirkecioglu, N. Bicak: Synthesis of 2-oxazolines via boron esters of N-(2-hydroxyethyl) amides. In: Tetrahedron Lett. Band 51, Nr. 40, 2010, S. 5313–5315, doi:10.1016/tetlet.2010.07.167.
- M.N. Holerca, V. Percec: 1H NMR Spectroscopic Investigation of the Mechanism of 2-Substituted-2-Oxazoline Ring Formation and of the Hydrolysis of the Corresponding Oxazolinium Salts. In: Eur. J. Org. Chem. Band 2000, Nr. 12, 2000, S. 2257–2263, doi:10.1002/1099-0690(200006)2000:12<2257::AID-EJOC2257>3.0.CO;2-2.
- S. Takahashi, H. Togo: An Efficient Oxidative Conversion of Aldehydes into 2-Substituted 2-Oxazolines Using 1,3-Diiodo-5,5-dimethylhydantoin. In: Synthesis. Band 14, 2009, S. 2329–2332, doi:10.1055/s-0029-1216843.
- H. Schlaad, R. Hoogenboom: Poly(2-oxazoline)s and Related Pseudo-Polypeptides. In: Macromol. Chem. Rapid Commun. Band 33, Nr. 19, 2012, S. 1599, doi:10.1002/marc.201200571.
- C. Guerrero-Sanchez, R. Hoogenboom, U.S. Schubert: Fast and “green” living cationic ring opening polymerization of 2-ethyl-2-oxazoline in ionic liquids under microwave irradiation. In: Chem. Commun. Band 36, 2006, S. 3797–3799, doi:10.1039/B608364A.
- M. Glassner, K. Lava, V.R. de la Rosa, R. Hoogenboom: Tuning the LCST of poly(2-cyclopropyl-2-oxazoline) via gradient copolymerization with 2-ethyl-2-oxazoline. In: Polym. Chem. Band 52, Nr. 21, 2014, S. 3118–3122, doi:10.1002/pola.27364.
- S. Motokucho, M. Furukawa, M. Kawashima, K. Kojio, K. Yoshinaga: Physical properties of poly(tetrahydrofuran)-block-poly(2-ethyl-2-oxazoline) triblock copolymer. In: Polym. J. Band 45, 2013, S. 1115–1119, doi:10.1038/pj.2013.39.
- V.R. de la Rosa: Poly(2-oxazoline)s as materials for biomedical applications. In: J. Mater. Sci. Mater. Med. Band 25, Nr. 5, 2013, S. 1–15, doi:10.1007/s10856-013-5034-y.
- Patent US20100197888A1: Method for manufacturing linear polyethyleneimine (PEI) for transfection purpose and linear PEI obtained with such method. Angemeldet am 31. Juli 2008, veröffentlicht am 5. August 2010, Anmelder: Polyplus Transfection, Erfinder: A. Adib, F. Stock, P. Erbacher.
- H.M.L. Lambermont-Thijs, F.S. van der Woerdt, A. Baumgaertel, L. Bonami, F.E. Du Prez, U.S. Schubert, R. Hoogenboom: Linear Poly(ethylene imine)s by Acidic Hydrolysis of Poly(2-oxazoline)s: Kinetic Screening, Thermal Properties, and Temperature-Induced Solubility Transitions. In: Macromolecules. Band 43, Nr. 2, 2010, S. 927–933, doi:10.1021/ma9020455.

