p-Toluolsulfonsäuremethylester
p-Toluolsulfonsäuremethylester (Methyltosylat) ist als Methylester der p-Toluolsulfonsäure das einfachste Tosylat, das als Methylierungsmittel und Katalysator für Alkydharze[3] sowie als Initiator für die Polymerisation von substituierten Oxazolinen zu Poly(2-oxazoline)n[5] Verwendung findet.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | p-Toluolsulfonsäuremethylester | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C8H10O3S | ||||||||||||||||||
| Kurzbeschreibung | |||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 186,23 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Dampfdruck |
1 hPa bei 20 °C[1] | ||||||||||||||||||
| Löslichkeit |
nahezu unlöslich in Wasser,[3] wenig löslich in Petrolether und Diethylether, löslich in Ethanol, Benzol und Chloroform[4] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Vorkommen und Darstellung
Die Reaktion von para-Toluolsulfonsäurechlorid mit Methanol in Gegenwart von Pyridin zur Neutralisation des entstehenden Chlorwasserstoffs liefert p-Toluolsulfonsäuremethylester in 70%iger Ausbeute.[6]
Mit festem Kaliumcarbonat als Säurefänger wird Methyltosylat in 96%iger Ausbeute erhalten.[7]
p-Toluolsulfonsäure reagiert mit Trimethylorthoformiat bei Raumtemperatur nach 14 Stunden bzw. unter Rückfluss für 30 Minuten in 99%iger Ausbeute zum p-Toluolsulfonsäuremethylester.[8]
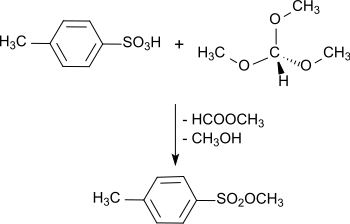
In Gegenwart von Fe3+-haltigem Montmorillonit reagiert auch p-Toluolsulfonsäure mit Methanol in 84%iger Ausbeute zum Sulfonsäureester.[9]
Statt des festen Katalysators Montmorillonit kann auch das feste Silicachlorid (aus Silicagel und Thionylchlorid[10][11]) für diese Veresterung verwendet werden.[12]
Eigenschaften
p-Toluolsulfonsäuremethylester ist ein farbloser bis schwach gelber kristalliner Feststoff, der in Wasser unlöslich, in einigen organischen Lösungsmitteln löslich ist.[4]
Anwendungen
p-Toluolsulfonsäuremethylester ist wie andere Tosylate (R-O-SO2-Phenyl-CH3) ein reaktives Methylierungsmittel und überträgt Methylgruppen auf nucleophile Verbindungen wie z. B. Alkohole, Phenole, Amine oder Thiole.[6]
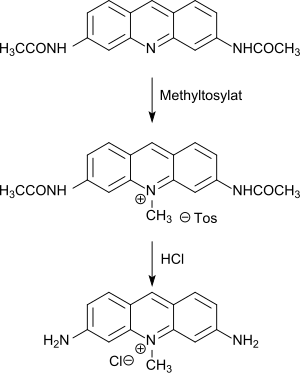
Ein Beispiel für die Alkylierung einer basischen Stickstoffverbindung mit Methyltosylat ist die Methylierung von 3,6-Bis(acetylamino)acridin zum 3,6-Bis(acetylamino)-10-methylacridiniumtosylat, aus dem mittels Chlorwasserstoff das Antiseptikum Acriflaviniumchlorid erhalten wird.[13]
Ein weiteres Beispiel ist die Methylierung von 2-Methylbenzthiazol zum entsprechenden N-Methylammoniumtosylat, das nach Austausch des Tosylat-Anions gegen das Tetrafluoroborat-Anion und Umsetzung mit dem Königschen Salz zu einem blauen Cyanin-Farbstoff reagiert.[14]

p-Toluolsulfonsäuremethylester wird zur Darstellung von quaternisierten Alkylketendimeren (AKD)-Derivaten (langkettigen Alkylamidoaminen) eingesetzt, die als Hydrophobierungsmittel für Papier oder zur Knitterfreiausrüstung von Textilien eingesetzt werden.[15]

Unter dem Aspekt der Atomökonomie als auch der Ökonomie ist Methyltosylat trotz höherer Reaktivität den billigeren Methylierungsmitteln Methylchlorid und Dimethylsulfat für Quaternisierungsreaktionen meist unterlegen.
In jüngerer Zeit hat Methyltosylat Anwendung als Initiator zur Polymerisation von 2-Alkyloxazolinen, wie z. B. 2-Ethyl-2-oxazolin gefunden,
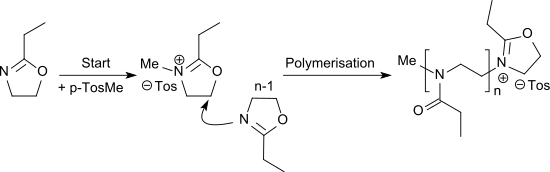
die insbesondere wegen ihrer hohen Biokompatibilität als vielfältig einsetzbare Materialien für biomedizinische Anwendungen diskutiert werden.[16]
Einzelnachweise
- Datenblatt p-Toluolsulfonsäure methylester bei Sigma-Aldrich, abgerufen am 30. Mai 2016 (PDF).
- Eintrag zu Methyl p-Toluenesulfonate bei TCI Europe, abgerufen am 30. Mai 2016.
- Datenblatt Methyl p-toluenesulfonate, 98% bei AlfaAesar, abgerufen am 30. Mai 2016 (PDF) (JavaScript erforderlich).
- David R. Lide: CRC Handbook of Chemistry and Physics, 75th Edition. CRC Press, Boca Raton, FL, U.S.A. 1994, ISBN 978-0-8493-0475-0, S. 3–62.
- E. Rossegger, V. Schenk, F. Wiesbrock: Review: Design Strategies for Functionalized Poly(2-oxazoline)s and Derived Materials. In: Polymers. Band 5, Nr. 3, 2013, S. 956–1011, doi:10.3390/polym5030956.
- K. Schwetlick: Organikum: Organisch-chemisches Grundpraktikum, 24. Aufl. Wiley-VCH, Weinheim 2015, ISBN 978-3-527-33968-6, S. 670.
- F. Kazemi, A.R. Massah, M. Javaherian: Chemoselective and scalable preparation of alkyl tosylates under solvent-free conditions. In: Tetrahedron. Band 63, Nr. 23, 2007, S. 5083–5087, doi:10.1016/j.tet.2007.03.083.
- A.A. Padmapriya, G. Just, N.G. Lewis: A new method for the esterification of sulfonic acids. In: Synth. Commun. Band 15, Nr. 12, 1985, S. 1057–1062, doi:10.1080/00397918508076842.
- B.M. Choudary, N.S. Chowdari, M.L. Kantam: Montmorillonite Clay Catalyzed Tosylation of Alcohols and Selective Monotosylation of Diols with p-Toluenesulfonic Acid: An Enviro-Economic Route. In: Tetrahedron. Band 56, Nr. 37, 2000, S. 7291–7298, doi:10.1016/S0040-4020(00)00626-8.
- D.H. Saunders, R.A. Barford, P. Magidman, L.T. Olszewski: Preparation and properties of a sulfobenzyl silica cation exchanger for liquid chromatography. In: Anal. Chem. Band 46, Nr. 7, 1974, S. 834–838, doi:10.1021/ac60343a042.
- F. Mohanazadeh, H. Amini: Silica chloride mediated alkylation of electron-rich aromatics by benzyl or tert-butyl chloride. In: Bull. Korean Chem. Soc. Band 31, 2010, S. 3038–3040, doi:10.5012/bkcs.2010.31.10.3038.
- B. Das, V.S. Reddy, M.R. Reddy: An efficient and selective tosylation of alcohols with p-toluenesulfonic acid. In: Tetrahedron Lett. Band 45, Nr. 36, 2004, S. 6717–6719, doi:10.1016/tetlet.2004.07.076.
- A. Kleemann, J. Engel: Pharmazeutische Wirkstoffe: Synthesen, Patente, Anwendungen, 2. neubearb. u. erw. Aufl. Thieme, Stuttgart, New York 1982, ISBN 3-13-558402-X, S. 14.
- Versuch 8.1.1.3: Bis-(3-methylbenzthiazol-2)-heptamethincyanin-tetrafluoroborat. (PDF; 12,1 kB) In: uni-wuerzburg.de. Universität Würzburg, abgerufen am 4. Juni 2016.
- Patent US8722926B2: Beta-ketocarbonylquat compounds and process for the preparation thereof. Angemeldet am 20. Juli 2011, veröffentlicht am 13. Mai 2014, Anmelder: Wacker Chemie AG, Erfinder: C. Herzig.
- R. Hoogenboom: Poly(2-oxazoline)s: A polymer class with numerous potential applications. In: Angew. Chem. Band 48, Nr. 43, 2009, S. 7978–7994, doi:10.1002/anie.200901607.

