Monoethanolamin
Monoethanolamin (nach IUPAC-Nomenklatur: 2-Aminoethan-1-ol, abgekürzt auch als MEOA bezeichnet) ist eine organisch-chemische Verbindung aus der Stoffgruppe der Aminoalkohole. Er ist deren einfachster Vertreter und wird als Grundstoff in der chemischen Industrie eingesetzt.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
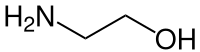 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Monoethanolamin | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | C2H7NO | |||||||||||||||||||||
| Kurzbeschreibung |
farblose, ölige Flüssigkeit mit ammoniakartigem Geruch[2] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 61,08 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
flüssig[2] | |||||||||||||||||||||
| Dichte |
1,02 g·cm−3 (20 °C)[2] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Siedepunkt |
172 °C[2] | |||||||||||||||||||||
| Dampfdruck | ||||||||||||||||||||||
| pKS-Wert |
9,50[3] | |||||||||||||||||||||
| Löslichkeit | ||||||||||||||||||||||
| Brechungsindex |
1,42592 (20 °C)[5] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| MAK | ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||||||||
Geschichte
Monoethanolamin wurde zusammen mit den anderen Ethanolaminen erstmals 1860 von Charles Adolphe Wurtz durch Reaktion von Ethylenchlorhydrin mit wässriger Ammoniak-Lösung hergestellt.[8]
Vorkommen
Monoethanolamin ist das biogene Amin der Aminosäure Serin. Ethanolamine kommen als polare Kopfgruppe im Phosphatidylethanolamin vor, das zur Gruppe der Phospholipide gehört. Phospholipide bilden im Wesentlichen die Lipiddoppelschicht in Zellmembranen aus. Weiterhin ist diese polare Kopfgruppe auch bei Endocannabinoiden zu finden.
Gewinnung und Darstellung

Monoethanolamin wird großtechnisch durch Umsetzung von Ethylenoxid mit wässriger Ammoniaklösung bei Temperaturen von 40–130 °C und einem Druck von 90–130 bar in Gegenwart eines stark sauren Kationenaustauschers als Katalysator hergestellt.[9]
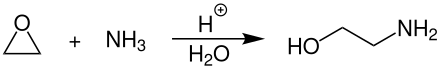
Als Nebenprodukte entstehen die höheren Ethanolamine, vor allem Diethanolamin und Triethanolamin. Durch einen Überschuss an Ammoniak kann der Anteil an Monoethanolamin stark erhöht werden. Die komplette Reaktion läuft bevorzugt in Rohr- oder Rohrbündelreaktoren ab. Die Reinigung und Aufarbeitung des Reaktionsgemisches erfolgt durch mehrstufige Destillation in Rektifikationskolonnen.[9]
Eigenschaften
Physikalische Eigenschaften
Monoethanolamin hat eine relative Gasdichte von 2,11 (Dichteverhältnis zu trockener Luft bei gleicher Temperatur und gleichem Druck) und eine relative Dichte des Dampf-Luft-Gemisches von 1,00 (Dichteverhältnis zu trockener Luft bei 20 °C und Normaldruck). Außerdem weist Ethanolamin einen Dampfdruck von 0,50 hPa bei 20 °C, 1,63 hPa bei 40 °C und 3,43 hPa bei 50 °C auf.[2] Die spezifische Verdampfungsenthalpie beträgt 848,1 kJ·kg−1, die spezifische Wärmekapazität wurde hingegen mit 2,72 kJ·kg−1·K−1 bestimmt. Die Viskosität beträgt 23,2 mPa·s bei 20 °C.[8]
Chemische Eigenschaften
Monoethanolamin ist eine schwer entzündbare Flüssigkeit aus der Stoffgruppe der Aminoalkohole. Sie ist mit Wasser und vielen Alkoholen mischbar. Des Weiteren ist Ethanolamin hygroskopisch und absorbiert Wasserdampf und Kohlenstoffdioxid. Die Flüssigkeit ist schwer bzw. sehr schwer flüchtig. Bei Kontakt mit Acrolein oder Acrylsäure kann der Stoff polymerisieren. Außerdem reagiert Monoethanolamin stark mit Oxidationsmitteln und Säuren sowie Eisen-Schwefel-Verbindungen. Eine wässrige Lösung der Konzentration 100 g/l weist bei 20 °C einen pH-Wert von 12,1 auf. Folglich reagieren Lösungen von Monoethanolamin stark alkalisch.[2][4]
Verwendung
Monoethanolamin wird verwendet:
- als Ersatz für Natronlauge in Backofenreinigern
- als Zusatz in Kühlschmierstoff
- in der Zellstoffindustrie als organisches Lösungsmittel
- in der Farbstoffindustrie
- als Mahlhilfsmittel für Zement
- als Zusatz in Reinigungsmitteln und Kosmetika (Fettsäure-Derivat für Detergenzien)[2]
- als Absorptionsmittel für Kohlenstoffdioxid und Schwefelwasserstoff in der Aminwäsche wie im Direct-air-capture-Verfahren oder in Atom-U-Booten
- als Zwischenprodukt bei der Herstellung von Tensiden
- in der Medizin
- Herstellung des Salzes Ethanolamin·HF, eines Hydrofluorides. Dieses patentierte[10][11] Aminfluorid wurde früher als Wirkstoff in einer Zahncreme unter dem Handelsnamen Biox Fluor® von der Knoll AG, Ludwigshafen, vermarktet.
- als Zwischenprodukt zur Herstellung von anderen chemischen Verbindungen wie zum Beispiel 2-Mercaptothiazol, Phenylethanolamin und Ethylendiamin.[12]
Sicherheitshinweise
Monoethanolamin ist eine schwer entzündbare Flüssigkeit. Die Dämpfe können mit Luft beim Erhitzen des Stoffes über seinen Flammpunkt explosive Gemische bilden. Der Stoff wird hauptsächlich über die Atemwege und die Haut aufgenommen. Dabei kann es von leichten Reizungen bis zu starken Verätzungen der Schleimhäute und der Haut kommen. Des Weiteren wurde eine hautsensibilisierende Wirkung festgestellt. Chronische Folgen können Hautveränderungen sein. Die Zündtemperatur beträgt 410 °C. Der Stoff fällt somit in die Temperaturklasse T2 und die Explosionsgruppe IIA. Mit einem Flammpunkt von 85 °C gilt Monoethanolamin als relativ schwer entflammbar.[2]
Risikobewertung
Monoethanolamin wurde 2012 von der EU gemäß der Verordnung (EG) Nr. 1907/2006 (REACH) im Rahmen der Stoffbewertung in den fortlaufenden Aktionsplan der Gemeinschaft (CoRAP) aufgenommen. Hierbei werden die Auswirkungen des Stoffs auf die menschliche Gesundheit bzw. die Umwelt neu bewertet und ggf. Folgemaßnahmen eingeleitet. Ursächlich für die Aufnahme von Monoethanolamin waren die Besorgnisse bezüglich hoher (aggregierter) Tonnage und weit verbreiteter Verwendung sowie der möglichen Gefahr durch sensibilisierende Eigenschaften. Die Neubewertung fand ab 2014 statt und wurde vom Vereinigten Königreich durchgeführt. Anschließend wurde ein Abschlussbericht veröffentlicht.[13][14]
Verwandte Verbindungen
Einzelnachweise
- Eintrag zu ETHANOLAMINE in der CosIng-Datenbank der EU-Kommission, abgerufen am 24. Oktober 2021.
- Eintrag zu 2-Aminoethanol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 3. März 2019. (JavaScript erforderlich)
- Hall, H.K., J. Am. Chem. Soc., 1957, 79, 5441.
- Eintrag zu Aminoethanole. In: Römpp Online. Georg Thieme Verlag, abgerufen am 3. März 2019.
- Malyanah Mohd Taib, Thanapalan Murugesan: Density, Refractive Index, and Excess Properties of 1-Butyl-3-methylimidazolium Tetrafluoroborate with Water and Monoethanolamine. In: Journal of Chemical & Engineering Data. Band 57, Nr. 1, 12. Januar 2012, ISSN 0021-9568, S. 120–126, doi:10.1021/je2007204.
- Eintrag zu 2-Aminoethanol im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 3. März 2019. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 141-43-5 bzw. 2-Aminoethanol), abgerufen am 14. September 2019.
- Matthias Frauenkron, Johann-Peter Melder, Günther Ruider, Roland Rossbacher, Hartmut Höke: Ethanolamines and Propanolamines. In: Ullmann’s Encyclopedia of Industrial Chemistry. Wiley‐VCH Verlag GmbH & Co. KGaA., 15. September 2001, doi:10.1002/14356007.a10_001.
- Patent WO2019154647A1: Verfahren zur Herstellung von C2-C4-Monoalkanolaminen mittels eines sauren Kationenaustauschers als Katalysator. Veröffentlicht am 15. August 2019, Anmelder: BASF SE, Erfinder: Christian Gruenanger, Gabriele Iffland, Zeljko Kotanjac, Hermann Luyken, Thomas Krug, Jian Zhong Yi, Johann-Peter Melder.
- Patent DE971375: Verfahren zur Herstellung einer alkalischen, seifenfreien, reagibles Fluor neben Calciumcarbonat enthaltenden Zahnpasta. Angemeldet am 26. August 1951, veröffentlicht am 15. Januar 1959, Anmelder: Knoll AG, Erfinder: Oskar Eichler, Kurt Kraft, Philipp Zut.
- Deutsche Zahnärztliche Zeitschrift, Bd. 7, S. 702 & 708 (1952)
- Klaus Weissermel, Hans-Jürgen Arpe, Charlet R. Lindley, Stephen Hawkins: Chap. 7. Oxidation Products of Ethylene. In: Industrial Organic Chemistry. Wiley-VCH, 2003, ISBN 3-527-30578-5, S. 159–161.
- Europäische Chemikalienagentur (ECHA): Substance Evaluation Report und Conclusion Document.
- Community rolling action plan (CoRAP) der Europäischen Chemikalienagentur (ECHA): 2-aminoethanol, abgerufen am 26. März 2019.

