Chemische Wasserstoffspeicher
Chemische Wasserstoffspeicher werden als neue Medien zur Speicherung und zum Transport von Wasserstoff erforscht. Dabei dienen diese Stoffe nur als Transportmedium und werden nicht verbraucht, sondern im Kreislauf geführt. Beispiele für derartige Stoffe sind flüssige organische Wasserstoffträgermaterialien („Liquid Organic Hydrogen Carriers“, LOHC).[1]
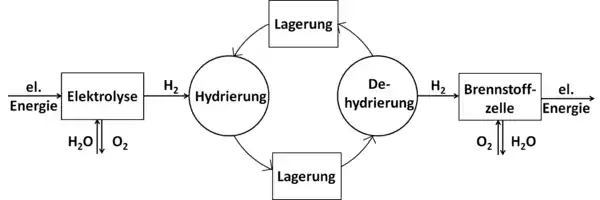
Das Prinzip der chemischen Wasserstoffspeicher ist, an einem „energiereichen“ Ort erzeugte Energie zu nutzen, um die energiearme Form des Trägerstoffs in einer chemischen Reaktion mit Energie, z. B. elektrolytisch hergestelltem Wasserstoff, zu beladen. Durch die Anreicherung mit Wasserstoff speichert das Medium dessen chemische Energie. Dieses mit Wasserstoff angereicherte Material kann verlustfrei über große Zeiträume gelagert, mit hoher Energiedichte transportiert und verteilt werden. Am Ort und zur Zeit des Energiebedarfs wird die energiereiche Form unter Freisetzung von Wasserstoff wieder energetisch entladen und zum Ort der Energieerzeugung zurückgebracht. Dort steht sie zur erneuten Energieaufnahme bereit.
Hierdurch lassen sich Leistungsschwankungen bei der Energieerzeugung auffangen. Somit kann die ursprünglich als elektrischer Strom vorliegende Energie gespeichert, transportiert und z. B. in Verbindung mit Brennstoffzellen wieder in Strom rückverwandelt werden. Bei geeigneter Integration des entsprechenden Speichersystems, beispielsweise in Wohnhäusern, kann die Abwärme des Prozesses genutzt werden, um das Gebäude zu beheizen.[2]
Wasserstoffspeicher im engeren Sinne
Als Wasserstoffspeicherung im engeren Sinne können chemische Konversionen von Wasserstoff gezählt werden, bei denen der Wasserstoff wieder als solcher zurückgewonnen wird und nicht irreversibel in einen anderen Brennstoff umgewandelt wird. Die wichtigsten Typen sind Metallhydride und Flüssige organische Wasserstoffträger.
N-Ethylcarbazol
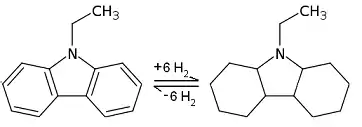
Gegenwärtig steht im Kern der aktuellen Forschung an Flüssigen Organischen Wasserstoffträgern eine Substanz, N-Ethylcarbazol, die Mitte der 2000er-Jahre von der US-Firma Air Products als Wasserstoffspeicher vorgeschlagen, patentiert und im Rahmen öffentlich geförderter Projekte untersucht wurde. Dieses wird in einem exothermen Prozess unter Druck und mit erhöhter Temperatur in die mit Wasserstoff „beladene“ Perhydro-Verbindung hydriert. Das könnte an einer Windkraftanlage oder einer Photovoltaikanlage geschehen. Dieses nun mit Energie angereicherte Material kann verlustfrei über große Zeiträume gelagert, mit hoher Energiedichte transportiert und unter Nutzung der heutigen Infrastruktur (Pipeline, Tankschiff, Tanklager, Tankstelle) verteilt werden. An der Verbrauchsstelle, z. B. in einem Brennstoffzellenfahrzeug wird unter Zufuhr von Wärme bei zwischen 100 und 200 °C der Wasserstoff wieder frei. Bei beiden Prozessen werden neuartige Katalysatoren eingesetzt.[1][3]
Die Perhydro-Verbindung hat einen Heizwert von 1,9 kWh/kg. Für die Erzeugung aus N-Ethylcarbazol müssen dem Prozess 2,8 kWh/kg zugeführt werden. Die Differenz (0,9 kWh/kg) fällt als Abwärme an und könnte an Ort und Stelle genutzt werden, um den Wirkungsgrad zu erhöhen. Der Heizwert der Perhydro-Verbindung liegt damit etwa bei einem Fünftel von Benzin. Da Brennstoffzellen aber erheblich effizienter arbeiten als Verbrennungsmotoren, lassen sich mit Carbazol Reichweiten konventioneller Pkw mit verdoppeltem Tankvolumen realisieren.[4] Bei der Speicherung elektrischer Energie mit Hilfe von N-Ethylcarbazol kann ein deutlich höherer energetischer Wirkungsgrad erreicht werden als bei vergleichbaren Ansätzen wie dem Sabatier-Prozess.[5]
Die Perhydro-Form von N-Ethylcarbazol ist wesentlich sicherer als der hochentzündliche Wasserstoff.
Methylcyclohexan
Bereits in den 1980er Jahren gab es weitreichende Versuche mit Toluol, das durch Hydrierung zu Methylcyclohexan umgewandelt wird. Die Grundidee dieser Variante kam 1975 aus den USA und wurde 1979 am Paul-Scherrer-Institut in der Schweiz zusammen mit der ETH Zürich weiterentwickelt. Der gesamte Kreislauf wird als Methylcyclohexan-Toluol-H2-System (MTH) bezeichnet.
Aufgrund der schwierigen Dehydrierbarkeit von nicht-heterocyclischen Verbindungen hat sich der Schwerpunkt der Forschung aber zu anderen Trägermaterialien hin verschoben.
Amminborane
Amminborane lassen sich prinzipiell ebenfalls hydrieren und dehydrieren. Die einfachste Form davon ist das Amminboran (NBH4 bzw. NBH6 im hydrierten Zustand). Im sauren Medium lässt sich hydriertes Amminboran hydrolysieren, wobei Wasserstoff freigesetzt wird.[6] Eine Regenerierung aus der entstehenden Ammonium-Borsäure-Lösung ist technisch jedoch nicht realisierbar. Dementsprechend handelt sich dabei eher um einen Einweg-Wasserstoffspeicher.
Eine katalytische Dehydrierung ohne Zersetzung des Ammoniumborans ist prinzipiell zwar möglich. Die Regenerierung aber dennoch schwierig. Als Alternative werden deshalb seit einiger Zeit heterocyclische Aminborane als potentielle Wasserstoffspeicher untersucht.[7] Der Schwerpunkt der entsprechenden Forschung liegt hier aber gegenwärtig noch auf der Synthese der Verbindungen, die sehr anspruchsvoll ist.[8]
Die Speicherdichte von Amminboranen wäre prinzipiell sehr hoch (12,1 Gew.-% bei NBH6; 7,1 Gew.-% bei C4NBH12). Da Amminborane aber nicht ohne Lösungsmittel handhabbar sind, ist die faktische Speicherdichte erheblich geringer.
Ameisensäure
Prinzipiell kann auch Ameisensäure als Trägersubstanz für Wasserstoff dienen. Durch katalytische Zersetzung lässt sich daraus Wasserstoff freisetzen.[9] Allerdings ist die Bildung von Ameisensäure aus Wasserstoff und Kohlenstoffdioxid thermodynamisch sehr ungünstig und die Synthese daher mit einem hohen Energiebedarf verbunden.[10]
Dibenzyltoluol
Seit 2016 wird Dibenzyltoluol, auch als Marlotherm bezeichnet, als Wasserstoffspeicher untersucht. Die Speicherkapazität beträgt 600 l Wasserstoff je Liter Dibenzyltoluol.[11]
Wasserstoffspeicher im weiteren Sinne
Daneben existieren auch Ansätze zur chemischen Wasserstoffspeicherung, bei denen in der Nutzungsphase der Wasserstoff nicht zurückgewonnen wird, sondern der "Wasserstoffspeicher" umgesetzt (verbrannt) wird. Der Träger wird bei all diesen Ansätzen nicht recycelt. Beispiele für mögliche Konversionsmethoden sind:
- Die Herstellung von Methan aus H2 und CO2 (vergl. Sabatier-Prozess, Windgas)
- Die Herstellung von Methanol aus H2 und CO2 bzw. CO
- Die Herstellung von Ammoniak aus H2 und N2 (vergl. Haber-Bosch-Verfahren)
- Die Hydrierung von Kohle (Bergius-Verfahren oder Fischer-Tropsch-Verfahren)
Dadurch, dass kein elementarer Wasserstoff zurückgewonnen wird, weicht die Art der Nutzung der gespeicherten Energie unter Umständen von der Wasserstoffspeicherung im engeren Sinne ab.
Einzelnachweise
- Daniel Teichmann, Wolfgang Arlt, Peter Wasserscheid, Raymond Freymann: A future energy supply based on Liquid Organic Hydrogen Carriers (LOHC). In: Energy and Environmental Science. Nr. 4, 2011, S. 2767–2773, doi:10.1039/C1EE01454D.
- Erlanger Forscher testen Energiespeicher der Zukunft. In: nordbayern.de. 11. August 2012, abgerufen am 24. August 2012.
- Strom lässt sich speichern - Forschung mit Wasserstoff läuft auf Hochtouren. In: vdi nachrichten.com. 12. August 2011, abgerufen am 11. Januar 2014.
- Bernd Otterbach: Wundermittel Carbazol: Der weite Weg in die Serie Automobilindustrie online, 7. Juli 2011.
- B. Müller, K. Müller, D. Teichmann, W. Arlt: Energiespeicherung mittels Methan und energietragenden Stoffen – ein thermodynamischer Vergleich. In: Chemie Ingenieur Technik. 83, No. 11, 2011, S. 1–13, doi:10.1002/cite.201100113
- F. H. Stephens, V. Pons, R. T. Baker: Ammonia–borane: the hydrogen source par excellence? In: Dalton Transactions. 25, 2007, S. 2613–2626. doi:10.1039/B703053C
- P. G. Campbell, L. N. Zakharov, D. J. Grant, D. A. Dixon, S.-Y. Liu: Hydrogen Storage by Boron−Nitrogen Heterocycles: A Simple Route for Spent Fuel Regeneration. In: Journal of the American Chemical Society. Vol. 132, 10, 2010, S. 3289–3291. doi:10.1021/ja9106622
- A. J. V. Marwitz, E. R. Abbey, J. T. Jenkins, L. N. Zakharov, S.-Y. Liu: Diversity through Isosterism: The Case of Boron-Substituted 1,2-Dihydro-1,2-azaborines. In: Organic Letters. Vol. 9, 3, 2010, S. 4905–4908. doi:10.1021/ol702383u
- B. Loges, A. Boddien, F. Gärtner, H. Junge, M. Beller: Catalytic Generation of Hydrogen from Formic acid and its Derivatives: Useful Hydrogen Storage Materials. In: Topics in Catalysis. Vol. 53, Nr. 13–14, 2010, S. 902–914 doi:10.1007/s11244-010-9522-8.
- I. Schmidt, K. Müller, W. Arlt: Evaluation of Formic-Acid-Based Hydrogen Storage Technologies. In: Energy & Fuels. Vol. 28, Nr. 10, 2014, S. 6540–6544 doi:10.1021/ef501802r.
- LOHC – Eine Pfandflasche für Wasserstoff, HZwei-Blog, 11. Mai 2016