Magnesiumhydrid
Magnesiumhydrid ist ein Hydrid des Leichtmetalls Magnesium mit der Formeleinheit MgH2.
| Kristallstruktur | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
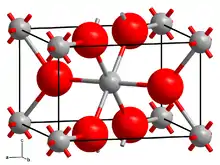 | ||||||||||||||||
| _ Mg2+ _ H− | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Magnesiumhydrid | |||||||||||||||
| Andere Namen | ||||||||||||||||
| Verhältnisformel | MgH2 | |||||||||||||||
| Kurzbeschreibung |
weißer Feststoff[2] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 26,321 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte |
1,45 g·cm−3[3] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit |
| |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Synthese
Zur Synthese von Magnesiumhydrid aus den Elementen Magnesium und Wasserstoff sind Verfahren beschrieben worden, die jedoch entweder sehr hohe Drücke und Temperaturen oder kompliziert handhabbare und zum Teil toxische Katalysatoren benötigen. Diese Verfahren sind daher ökonomisch (und ökologisch) ungünstig.
So kann die Reaktion zum Beispiel mit einem Gemisch aus Alkyliodid, Propargylbromid und Iod als Katalysator gewonnen werden.[5]
Möglich ist auch die Hochdruckreaktion eines Magnesiumhalogenids wie Magnesiumiodid gelöst in Ether mit Natriumhydrid.[5]
Bei der Hydrierung von Magnesium wird Energie (Wärme) frei, sodass sie eigentlich spontan weiterlaufen sollte. Die Reaktion ist jedoch in ihrer Ablaufgeschwindigkeit erheblich gehemmt (kinetische Hemmung). Katalysatoren können diese Hemmschwelle erniedrigen. Magnesiumhydrid selbst katalysiert seine eigene Bildung (Autokatalyse), wie Wilfried Knott herausfand. Bei Anwesenheit von wenig Magnesiumhydrid ist die weitere Bildung unter mittleren Druck- und Temperaturbedingungen möglich.
Das so hergestellte Produkt ist ein graues Pulver, mit wenig Magnesium-Verunreinigungen.
Ebenfalls möglich ist die Herstellung durch Erhitzen von Magnesiumdialkylen (z. B. Magnesiumdiethyl, Magnesiumdibutyl, Magnesiumdiphenyl) oder entsprechenden Grignard-Verbindungen im Hochvakuum.[5]
Eigenschaften
Aktiviertes fein verteiltes Magnesiumhydrid ist pyrophor, makrokristallines Magnesiumhydrid entzündet sich jedoch nicht an der Luft, sondern benötigt dazu mehr als 300 Grad Celsius. Magnesiumhydrid reagiert, wie die meisten Metallhydride, heftig mit Wasser unter Abspaltung von Wasserstoff.
Bei normalem Luftdruck (bei 1 Bar) zersetzt es sich ab einer Temperatur von 287 °C unter Bildung von Wasserstoff.[6]
Magnesiumhydrid kann in mehreren polymorphen Formen kristallisieren. Das bei Umgebungsbedingungen stabile α-MgH2 hat eine tetragonale TiO2-Struktur vom Rutil-Typ. Bei hohen Drücken von mehr als 0,39 GPa wandelt sich dieses Hydrid in eine metastabile, unter normalen Bedingungen modifizierte γ-Form um, die mit einer orthorhombischen Struktur vom Typ α-PbO2 kristallisiert. Weitere Untersuchungen mittels XRD zeigen, dass unterschiedliche Drücke zur Bildung des metastabilen orthorhombischen γ-MgH2 zusammen mit tetragonalem α-MgH2 führen. Die γ-Polymorphie kann auch durch mechanochemische Behandlung von Magnesiumhydrid erhalten werden. Ein β-Modifikation in Form einer kubisch modifizierte CaF2-Struktur wurde ebenfalls berichtet, die experimentell mit In-situ-Synchrotronbeugung beobachtet wurde und bei sehr hohem Druck stabil ist.[7] Bei hohen Drücken von bis zu 16 GPa sind weitere Modifikationen bekannt.[8]
Verwendung
Das MgH2-Mg-System besitzt von allen bekannten Metallhydrid-Metall-Systemen, die als Wasserstoffspeicher diskutiert werden, den höchsten Gewichtsanteil an reversibel gebundenem Wasserstoff (7,65 Gew.-%) und damit die höchste Energiedichte je Gewichtseinheit Speichermaterial (2,33 kWh/kg).[9]
In einem Kilogramm Hydrid kann somit bis zu 800 Liter Wasserstoffgas als Hydrid gespeichert werden. Zwar besitzt gewöhnlicher Treibstoff wie z. B. Benzin eine deutlich höhere Energiedichte, im Vergleich aber zu Batterien oder Flüssiggasspeichern ist die Energiedichte höher. Zu beachten ist allerdings, dass die effektive Energiedichte geringer ist, da für die Freisetzung des Wasserstoffs Energie in Form von Wärme benötigt wird. Da der Wasserstoff zudem bei höheren Temperaturen reversibel abgegeben werden kann, ist eine Anwendung als Wasserstoffspeicher möglich. Ein aktueller Forschungsschwerpunkt liegt in der Reduzierung der benötigten höheren Temperatur zur Wasserstofffreisetzung, um eine praktische Verwendung zu ermöglichen.[10][11]
Durch Wasserstoff, der aus Magnesiumhydrid freigesetzt wird, können Metallschäume erzeugt werden.[12] Theoretisch können damit zum Beispiel Aluminiumschäume erzeugt werden, deren Dichte geringer ist als die von Wasser.[13]
Einzelnachweise
- Eintrag zu MAGNESIUM HYDRIDE in der CosIng-Datenbank der EU-Kommission, abgerufen am 20. November 2021.
- Datenblatt Magnesiumhydrid bei AlfaAesar, abgerufen am 14. März 2010 (PDF) (JavaScript erforderlich).
- Eintrag zu Magnesiumhydrid. In: Römpp Online. Georg Thieme Verlag, abgerufen am 14. Juli 2014.
- Datenblatt Magnesium hydride bei Sigma-Aldrich, abgerufen am 9. April 2011 (PDF).
- Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band II, Ferdinand Enke, Stuttgart 1978, ISBN 3-432-87813-3, S. 902.
- T. R. McAuliffe: Hydrogen and Energy. Springer, 1980, ISBN 978-1-349-02635-7, S. 65 (books.google.de).
- J.-C. Crivello, B. Dam, R. V. Denys, M. Dornheim, D. M. Grant, J. Huot, T. R. Jensen, P. de Jongh, M. Latroche, C. Milanese, D. Milčius, G. S. Walker, C. J. Webb, C. Zlotea, V. A. Yartys: Review of magnesium hydride-based materials: development and optimisation. In: Applied Physics A. Band 122, Nr. 2, 2016, ISSN 1432-0630, S. 97, doi:10.1007/s00339-016-9602-0.
- P. Vajeeston, P. Ravindran, B. C. Hauback, H. Fjellvåg, A. Kjekshus, S. Furuseth, M. Hanfland: Structural stability and pressure-induced phase transitions in MgH2. In: Physical Review B. Band 73, Nr. 22, 2006, S. 224102, doi:10.1103/PhysRevB.73.224102 (aps.org).
- Götz Koerner, Klaus-Dieter Klein, Wilfried Knott: Neue Synthesen von Magnesiumhydrid / New Syntheses of Magnesium Hydride. In: Zeitschrift für Naturforschung B. Band 47, Nr. 6, 1992, ISSN 1865-7117, S. 767–771, doi:10.1515/znb-1992-0603 (degruyter.com).
- Thomas Klassen: Hochtemperatur-Metallhydride: Energiespeicher für das emissionsfreie Automobil. 2001, abgerufen am 3. Dezember 2021.
- Ferdi Schüth: Mobile Wasserstoffspeicher mit Hydriden der leichten Elemente. In: Nachrichten aus der Chemie. Band 54, Nr. 1, 2006, ISSN 1868-0054, S. 24–28, doi:10.1002/nadc.20060540111 (wiley.com).
- Günther Lange: Metallschäume: Herstellung, Eigenschaften, Potenziale und Forschungsansätze – mit Schwerpunkt auf Aluminiumschäume. Walter de Gruyter & Co KG, 2020, ISBN 978-3-11-068179-6 (books.google.de).
- Iva Nová, Karel Fraňa, Jiří Machuta, Iva Nováková: Theoretical Calculations of the Foaming Properties of Powder Agents for the Production of Aluminium Foams. In: Manufacturing Technology. Band 19, Nr. 1, 2019, S. 118–122, doi:10.21062/ujep/254.2019/a/1213-2489/MT/19/1/118 (journalmt.com).

