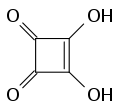
Quadratsäure
Die Quadratsäure ist ein Abkömmling des Cyclobutens, gehört zur Gruppe der Oxokohlenstoffe und ist verwandt mit der Semiquadratsäure (Moniliformin), dem sauersten bekannten Naturstoff. Die Salze der Quadratsäure heißen Quadratate.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Quadratsäure | |||||||||||||||
| Andere Namen |
3,4-Dihydroxycyclobut-3-en-1,2-dion | |||||||||||||||
| Summenformel | C4H2O4 | |||||||||||||||
| Kurzbeschreibung |
beigefarbener Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 114,06 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte |
1,82 g·cm−3[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Dampfdruck |
< 0,01 hPa bei 20 °C[1] | |||||||||||||||
| pKS-Wert | ||||||||||||||||
| Löslichkeit |
gut löslich in Wasser (20 g·l−1 bei 20 °C)[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Darstellung
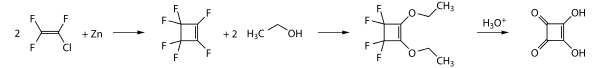
Die erste Darstellung von Quadratsäure erfolgte durch Umsetzung von Chlortrifluorethylen mit Zink. Das dabei entstehende Perfluorcyclobuten wird in Ethanol zu 1,2-Diethoxy-3,3,4,4-tetrafluor-1-cyclobuten umgesetzt. Durch saure Hydrolyse entsteht schließlich die Quadratsäure.[3]
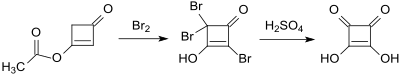
Weniger umständlich und kostengünstiger ist die industrielle Herstellung der Quadratsäure aus dem als Destillationsrückstand bei der Herstellung von Diketen anfallenden Triketen (3-Acetoxy-2-cyclobuten-1-on). Bei dessen Halogenierung, z. B. mit Brom, entsteht fast quantitativ (96 % Ausbeute) das Tribromierungsprodukt (2,2,4-Tribrom-3-hydroxy-2-cyclobuten-1-on), das mit konzentrierter Schwefelsäure direkt zum Zielprodukt (85 % Ausbeute) reagiert.[4]
Eigenschaften
Der Name Quadratsäure ist eigentlich nicht korrekt, da die vier Kohlenstoffatome aufgrund unterschiedlicher C–C-Bindungslängen kein Quadrat bilden. In kristallinen Zustand ordnen sich die planaren C4O4-Untereinheiten über Wasserstoffbrückenbindungen zu einer ebenen Schicht an.
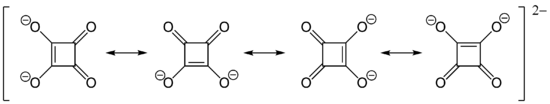
Die hohe Acidität (pKs1 = 1,5, pKs2 = 3,4) der Quadratsäure lässt sich, ähnlich wie z. B. bei der Delta-, Crocon- oder der Rhodizonsäure, durch Resonanzstabilisierung des Anions erklären. Das Dianion der Quadratsäure ist völlig symmetrisch gebaut und zeigt keine unterschiedlichen C–C- bzw. C–O-Bindungslängen:
Ebenso wie bei den Anionen der anderen oben erwähnten Säuren (Oxokohlenstoffe) handelt es sich um ein aromatisches System mit 2 π-Elektronen.[5]
Verwendung
Salze der Quadratsäure
Quadratsäure bildet Salze, die so genannten Quadratate, u. a. mit komplexen Übergangsmetallionen und zinnorganischen Verbindungen, wie z. B.
- Quadratsäure wurde als Baustein zur Synthese von neuen Poly-alkoxo-oxometallat-Derivaten, wie z. B. dem K4[VIV12O12(OCH3)16(C4O4)6] eingesetzt. Dazu wurde ortho-Vanadinsäuremethylester mit Quadratsäure und Kaliumhydroxid unter Solvothermalbedingungen umgesetzt.[6]
- Auch zur Darstellung neuer Organozinnverbindungen wurde Quadratsäure verwendet. So gelang 2004 durch Umsetzung von Trimethylzinnchlorid, Tributylzinnchlorid bzw. Dimethylzinndichlorid mit Dinatriumquadratat die Synthese von Bis(trimethyl)-, Bis(tributylzinn)- bzw. Dimethylzinnquadratat.[7]
Derivate der Quadratsäure
Quadratsäure verhält sich wie eine starke dibasische Carbonsäure, vergleichbar in ihrer Acidität mit Oxalsäure. Mit Alkoholen, wie z. B. n-Butanol reagiert Quadratsäure zu dem Diester Quadratsäuredibutylester (engl. squaric acid dibutylester SADBE), mit Thionylchlorid entsteht das Säurechlorid Dichlorcyclobutendion, das sich leicht in die entsprechenden Ester und Säureamide überführen lässt.[8][9]
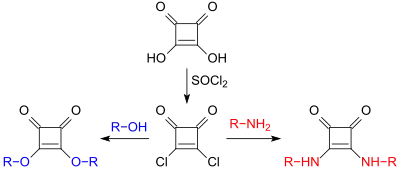
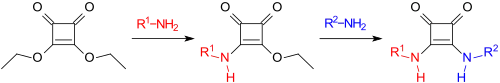
Das bei der Reaktion des Diesters mit Aminen zunächst gebildete Esteramid kann gezielt zum symmetrischen (R1=R2) oder unsymmetrischen (R1≠R2) Diamid umgesetzt werden.[10][11]
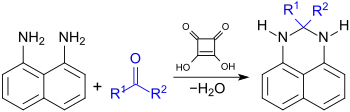
Aufgrund seiner hohen Acidität eignet sich Quadratsäure als saurer Katalysator für Kondensationsreaktionen, wie z. B. bei der Synthese von tricyclischen Dihydro-Perimidinen[12] und Perimidinen, die einfach aus der Pigmentvorstufe 1,8-Diaminonaphthalin zugänglich und wegen ihrer vielseitigen medizinischen und technischen Anwendungen interessant sind.[13]
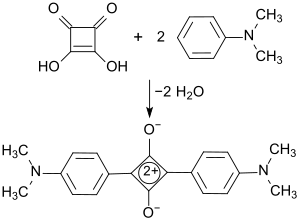
Wichtigste Verwendung von Quadratsäure ist als Ausgangsstoff für die Synthese von photoleitenden Squarainen[14], die in Xerographie und Elektrochemilumineszenz[15], sowie als wirksame Absorber-Emitter im Nahinfrarot-(NIR)-Bereich eingesetzt werden.
Medizinische Anwendungen der Quadratsäure
Mit der Quadratsäure können Warzen behandelt werden.[16] Bei der als Immuntherapie genannten Behandlung wird zuerst eine irritative Konzentration (2-3%ige Lösung in Aceton) aufgebracht. Wenn eine immunologische Reaktion auftritt, kann die Warze mit wesentlich niedriger konzentrierten Lösung behandelt werden.
Neben Diphenylcyclopropenon (DPCP) wird Quadratsäuredibutylester (SADBE) zur Behandlung des Haarausfalls eingesetzt. Im Rahmen einer topischen Immuntherapie bei therapieresistenter Alopecia areata bzw. Alopecia totalis erfolgt eine gezielte Kontaktsensibilisierung der Kopfhaut mit verdünnter Quadratsäurelösung.[17]
Der Einsatz von Quadratsäure als Linker zwischen Targetstrukturen und Chelatoren für den Einsatz in der molekularen Bildgebung ist Gegenstand aktueller Forschung.[18][19]
Polyamide mit Quadratsäure
Im Arbeitskreis von Georg Manecke wurden Polyamide mit Quadratsäure bzw. Quadratsäureestern als Dicarbonsäurekomponente synthetisiert. Dazu wird das zunächst analog zum AH-Salz für Nylon 6,6 gebildete Quadratsäure-Diaminsalz in Ameisensäure als Lösungsmittel unter Stickstoff und anschließend unter Vakuum erhitzt. Die erhaltenen Polymere sind farblos bis schwach gelb und außerordentlich temperaturstabil (Schmelzpunkt > 350 °C). Mit Quadratsäure als Disäure werden vorwiegend 1,3-, mit Quadratsäureestern bevorzugt 1,2-Polyamide gebildet.[20][21]
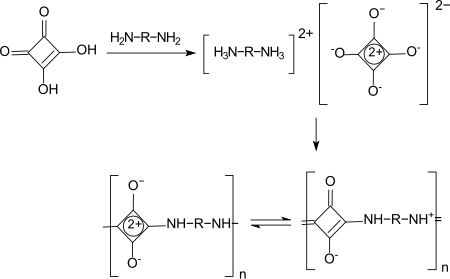
Quadratsäure-1,3-Polyamide haben bisher keine kommerzielle Anwendungen gefunden.
Siehe auch
Einzelnachweise
- Datenblatt Quadratsäure (PDF) bei Merck, abgerufen am 26. Dezember 2019.
- Robert West, David L. Powell: „New Aromatic Anions. III. Molecular Orbital Calculations on Oxygenated Anions“, in: J. Am. Chem. Soc., 1963, 85 (17), S. 2577–2579; doi:10.1021/ja00900a010.
- Sidney Cohen, John R. Lacher, Joseph D. Park: „Diketocyclobutenediol“, in: J. Am. Chem. Soc., 1959, 81 (13), S. 3480–3480; doi:10.1021/ja01522a083.
- Patent EP0442431B1: Verfahren zur Herstellung von Quadratsäure. Angemeldet am Februar 1991, veröffentlicht am 11. Mai 1994, Anmelder: Lonza AG.
- Eintrag zu Quadratsäure. In: Römpp Online. Georg Thieme Verlag, abgerufen am 15. Juni 2014.
- Johann Spandl, Irene Brüdgam, Hans Hartl: „Von kleinen Bausteinen zu neuen Poly-alkoxo-oxometallat-Derivaten: Synthese und Strukturaufklärung von K4[VIV12O12(OCH3)16(C4O4)6], Cs10[VIV24O24(OCH3)32(C4O4)12][VIV8O8(OCH3)16(C2O4)] und M2[VIV8O8(OCH3)16(VIVOF4)] (M = [N(nBu)4] bzw. [NEt4])“, in: Z. anorg. allg. Chem., 2003, 629 (3), S. 539–544; doi:10.1002/zaac.200390087.
- Asrial: Synthese und Charakterisierung neuer Organozinnverbindungen, Cuvillier Verlag, Göttingen 2004, ISBN 3-86537-259-7 (eingeschränkte Vorschau in der Google-Buchsuche).
- A.H. Schmidt: Reaktionen von Quadratsäure und Quadratsäure-Derivaten. In: Synthesis. Band 12, 1980, S. 961–994, doi:10.1055/s-1980-29291.
- A. Mukkanti, M. Periasamy: Methods of synthesis of cyclobutenediones. In: Arkivoc. xi, 2005, S. 48–77 (www.arkat-usa.org/get-file/20385/).
- L. Tietze, M. Arlt, M. Beller, K.-H. Glüsenkamp, E. Jähde, M.F. Rajewsky: Anticancer Agents, 15. Squaric Acid Diethyl Ester: A New Coupling Reagent for the Formation of Drug Biopolymer Conjugates. Synthesis of Squaric Acid Ester Amides and Diamides. In: Chem. Ber. Band 124, Nr. 5, 1991, S. 1215–1221, doi:10.1002/cber.19911240539.
- F.R. Wurm, H.-A. Klok: Be squared: expanding the horizon of squaric acid-mediated conjugations. In: Chem. Soc. Rev. Band 42, Nr. 21, 2013, S. 8220–8236, doi:10.1039/c3cs60153f.
- S. Khopar, G. Shankarling: Squaric acid: an impressive organocatalyst for the synthesis of biologically relevant 2,3-dihydro-1H-perimidines in water. In: J. Chem. Sciences. Band 132, Nr. 31, 2020, doi:10.1007/s12039-019-1735-1.
- N. Sahiba, S. Agarwal: Recent advances in the synthesis of perimidines and their applications. In: Top Curr. Chem. Band 378, Nr. 44, 2020, doi:10.1007/s41061-020-00307-5.
- K.-Y. Law, F.C. Bailey: Squaraine chemistry. Synthesis of bis(4-dimethylaminophenyl)squaraine from dialkyl squarates. Mechanism and scope of the synthesis. In: Can. J. Chem. Band 64, Nr. 12, 1986, S. 2267–2273, doi:10.1139/v86-372.
- L. Zhang et al.: Electrogenerated chemiluminescence of bis[4-(dimethylamino)phenyl]squaraine. In: Chem. Commun. Band 47, Nr. 13, 2011, S. 3855–3857, doi:10.1039/C0CC05818A.
- Nooshin Bagherani: Efficacy of squaric acid dibutyl ester in treatment of recalcitrant warts in children. In: Dermatologic Therapy. Band 28, Nr. 5, 2015, S. 330, doi:10.1111/dth.12234.
- P. Freyschmidt-Paul, R. Happle, R. Hoffmann: Alopecia areata – Klinik, Pathogenese und rationale Therapie einer T-Zell-vermittelten Autoimmunerkrankung. In: Der Hautarzt. Band 54, 2003, S. 713–722; doi:10.1007/s00105-003-0560-z.
- Sebastian Görres: Entwicklung neuer Liganden zur Fibrose-Bildgebung mittels PET und SPECT. In: unveröffentlichte Dissertation. Hannover 2016, S. 46 (d-nb.info).
- Deutsche Gesellschaft für Nuklearmedizin e.V.: Deutsche Gesellschaft für Nuklearmedizin e.V. Abgerufen am 21. September 2018.
- G. Manecke, L. Gauger: Polare Polyamide. In: Makromol. Chem. Band 125, Nr. 1, 1969, S. 231–246, doi:10.1002/macp.1969.021250122.
- G. Manecke, L. Gauger: Squaric Acid-1,3-Polyamides. In: Makromol. Synth. Band 1, 1969, S. 1–3 (pslc.ws [PDF]).