Squaraine
Als Squaraine bezeichnet man seit 1980[1] eine Klasse von intensiven Farbstoffen, deren Basis die Quadratsäure bzw. deren Ester sind. Sie werden im deutschsprachigen Raum daher manchmal auch als Quadratsäurefarbstoffe bezeichnet, ältere – heute nicht mehr verwendete – Bezeichnungen sind Tetracyclotrimethine, Cyclobutendiylium-Farbstoffe oder substituierte Oxocyclobutenolate.
Allgemeines
Aufgrund ihrer ungewöhnlichen strukturellen, elektronischen und photophysikalischen Eigenschaften sind Squarainfarbstoffe nicht nur von wissenschaftlichem Interesse. Sie zeigen eine hohe thermische und photochemische Stabilität und wurden daher kurz nach ihrer Entdeckung als Sensibilisatoren für anorganische Photoleiter eingesetzt.[2] Einige Zeit später wurden Squaraine auch als chemische Sensoren und als xerographische Photorezeptoren verwendet.[3][4][5] Heute ist man besonders daran interessiert, Squarainstrukturen in konjugierte Polymere einzubinden. Dies soll den Weg für neue leitende bzw. photoleitende Materialien öffnen.
Definition und Entdeckung
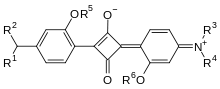
Die Squaraine wurden Mitte der 1960er Jahre von zwei Arbeitsgruppen gleichzeitig und unabhängig voneinander entdeckt.[3] Ihr Name Squarain ist eine Kombination von Squaric acid, dem englischen Begriff für die Quadratsäure, und Betain, womit zwitterionische Moleküle mit negativem und positivem Ladungszentrum bezeichnet werden.[1]
Die Squaraine sind stets 1,3-Dikondensationsprodukte der Quadratsäure mit nukleophilen Verbindungen und enthalten damit alle eine Cyclobutendiylium-1,3-diolat-Einheit. Als Nukleophile können z. B. primäre und sekundäre Amine, elektronenreiche aromatische und heteroaromatische Verbindungen dienen.
Diese Grundstruktur der Squaraine erklärt auch deren intensive Farbigkeit. Formal gesehen entspricht der zentrale Squarain-Vierring einem Hückelaromaten mit zwei π-Elektronen. Somit ist eine Elektronenkonjugation über das gesamte, planar gebaute Molekül hinweg möglich. Die beiden in Regel elektronenreichen Aryl-Reste schieben Elektronen in den elektronenarmen Vierring. Das Ergebnis ist ein Donor-Akzeptor-Donor-System mit starken intramolekularen charge-transfer-Effekten.
In Abhängigkeit vom Aufbau werden die Verbindungen in symmetrische und in unsymmetrische Squaraine unterteilt. Als unsymmetrische Squaraine bezeichnet man Quadratsäurederivate, die in der 1- und 3-Position unterschiedliche Substituenten tragen, symmetrische Squaraine tragen dagegen gleiche Substituenten.
Synthese der Squaraine
In der Literatur werden verschiedene Wege der Squarainsynthese diskutiert. Die drei wichtigsten seien hier vorgestellt.
Direkte Aromat-Quadratsäure-Kondensation
Dabei wird durch Erhitzen von Quadratsäure in einem Alkohol (meist Butanol) ein Quadratsäure-Halbester gebildet.[6] Das aromatische Nucleophil greift am vinylogen Esterkohlenstoff an und substituiert die Alkoxygruppe unter Abspaltung des entsprechenden Alkohols. An dieses 1:1-Addukt kann dann ein weiteres Nucleophil in trans-Position zum ersten Nucleophil an den Carbonylkohlenstoff des Vierrings addiert werden. Der entscheidende Nachteil dieses Syntheseweges ist die eingeschränkte Synthesevielfalt, die sich durch die Notwendigkeit der Verwendung elektronenreicher, sterisch wenig anspruchsvoller Aryle ergibt.
Ketendimerisierung
Der zweite Weg basiert auf einer Dimerisierung von Ketenen. Diese werden dazu in situ durch Dehydrochlorierung von Phenylacetylchloriden generiert. Die dabei entstehenden Ketene reagieren in einer [2+2]-Cycloaddition zu einem Dihydrosquarain,[7] aus dem man durch Oxidation das gewünschte Squarain erhält.[8] Der Vorteil dieses Syntheseweges ist, dass auch elektroenärmere Arylsysteme eingesetzt werden können. So gelingt z. B. die Synthese des Bis(4-methoxyphenyl)squarains nur über diesen Weg.[9]
Synthese über Halbsquarainaddukte
Halbsquaraine (also 4-Aryl-1-hydroxy-cyclobuten-3,4-dione) können auf drei Wegen dargestellt werden; das gewünschte Squarain erhält man dann durch Kondensation mit aktivierten Aromaten.[10][11]
- In einer [2+2]-Cycloaddition wird Phenylketen mit Tetraethoxyethylen umgesetzt; das entstehende Zwischenprodukt wird hydrolysiert.[12]
- Der zweite Weg ist die Lewis-Säure-katalysierte Friedel-Crafts-Reaktion zwischen Quadratsäuredichlorid und einem Aromaten mit anschließender Hydrolyse.[13]
- Die dritte Möglichkeit ist eine nucleophile 1,2-Addition von Lithiumarylverbidungen an eine Carbonylgruppe des jeweiligen Quadratsäureesters, gefolgt von einer Oxy-Eliminierung und anschließender Hydrolyse.[14]
Anwendungen der Squaraine
Die ersten Squaraine wurden 1965 von Treibs und Jacob entdeckt. Sie kondensierten Quadratsäure mit substituierten Pyrrolen und erhielten als Ergebnis tieffarbige, thermisch hoch beständige Verbindungen.[15] Darauf folgten Squaraine auf der Basis von N,N-Dialkyl-Anilin-Derivaten. Diese sich daraus ergebenden Bis(N,N-dialkylaminophenyl)squaraine stellen bis heute eine bedeutende Klasse dar.[16] Es folgten durch Kondensation mit Pyrazolon-, Benzothiophen- und Barbitursäure-Derivaten gewonnene Squaraine.[17]
Ursprünglich setzte man Squaraine als Sensibilisatoren für ZnO-Photoleiter ein,[8] in den 1970er Jahren untersuchte man ihre Anwendungsmöglichkeiten im Bereich der Solartechnik.[9] Da Squaraine eine intensive Absorption im nahen Infrarotbereich zeigen, ist auch ein Einsatz in optischen Speichermedien[11] bzw. als Laserfarbstoffe[12] möglich.
In den 1990er Jahren wurde die Forschung zu Squarain-Synthesen aufgrund ihrer attraktiven photophysikalischen Eigenschaften wieder aufgegriffen. Durch die Einführung von höher substituierten Aromaten mit zusätzlichen hypsochromen oder bathochromen Gruppen in ortho- und/oder meta-Position können die Eigenschaften wie Löslichkeit, Kristallbildung oder Lichtabsorption gesteuert werden. Das Ziel ist die Verbesserung der technischen Photoleitfähigkeit und anderer xerographischer Eigenschaften.[18]
Heute werden Squaraine hauptsächlich als Fluoreszenzfarbstoffe in der DNA-Sequenzanalyse[13] sowie als Materialien für die Nichtlineare Optik (NLO) verwendet.[14] Seit Ende der 1990er Jahre konzentriert sich die Forschung auf die Synthese von Oligo- und Polysquarainen sowie auf chirale Squaraine.[19]
Einzelnachweise
- A. H. Schmidt. In: Synthesis 1980, S. 961–994.
- H. Kampfer, K. E. Verhille. U.S.Patent 3617270, 1971.
- K. Y. Law. In: J. Phys. Chem. 92 (1988), S. 4226–4231.
- Y. G. Isgor, E. U. Akkaya. In: Tetrahedron Lett. 38 (1997), S. 7417–7420.
- E. U. Akkaya, S. Turkyilmaz. In: Tetrahedron Lett. 38 (1997), S. 4513–4516.
- K. Y. Law, F. C. Bailey: Squaraine chemistry. Synthesis of bis(4-dimethylaminophenyl)squaraine from dialkyl squarates. Mechanism and scope of the synthesis. In: Canadian Journal of Chemistry. 64, 1986, S. 2267–2273, doi:10.1139/v86-372.
- D. G. Farnum, J. R. Johnson, R. E. Hess, T. B. Marshall, B. Webster. In: J. Am. Chem. Soc. 87 (1965), S. 5191–5197.
- D. G. Farnum, B. Webster, A. D. Wolf. In: Tetrahedron Lett. 1968, S. 5003–5006.
- M. A. B. Block: Synthese und Charakterisierung von Polysquarainstrukturen. Diplomarbeit, FU Berlin 2002.
- K. Y. Law, F. C. Bailey. In: J. Org. Chem. 57 (1992), S. 3278–3286.
- K. Y. Law, F. C. Bailey: Squaraine chemistry. A new approach to symmetrical and unsymmetrical photoconductive squaraines. Characterization and solid state properties of these materials. In: Canadian Journal of Chemistry. 71 (4), 1993, S. 494–505, doi:10.1139/v93-070.
- D. Bellus. In: J. Am. Chem. Soc. 100 (1978), S. 8026.
- G. Maahs, P. Hegenberg. In: Angew. Chem. 78 (1966), S. 927–931.
- M. W. Reed, D. J. Pollart, S. T. Perri, L. D. Foland, H. W. Moore,. In: J. Org. Chem. 53 (1988), S. 2477–2482.
- A. Treibs, K. Jacob. In: Angew. Chem. 77 (1965), S. 680–681.
- H. E. Sprenger, W. Ziegenbein. In: Angew. Chem. 78 (1966), S. 937–938.
- H. E. Sprenger, W. Ziegenbein. In: Angew. Chem. 80 (1968), S. 541–546.
- K. Y. Law. In: Chem. Rev. 93 (1993), S. 449–486.
- Manuela Schiek, Oriol Arteaga, Arne Lützen, Frank Balzer, Stefanie Brück: Giant intrinsic circular dichroism of prolinol-derived squaraine thin films. In: Nature Communications. Band 9, Nr. 1, 20. Juni 2018, ISSN 2041-1723, S. 2413, doi:10.1038/s41467-018-04811-7 (nature.com [abgerufen am 19. April 2019]).