Dimethylzinndichlorid
Dimethylzinndichlorid ist eine chemische Verbindung aus der Gruppe der zinnorganischen Verbindungen.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
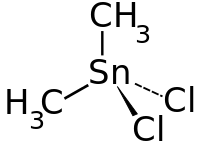 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Dimethylzinndichlorid | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C2H6Cl2Sn | |||||||||||||||
| Kurzbeschreibung |
weißer Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 219,66 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
188–190 °C[1] | |||||||||||||||
| Löslichkeit |
leicht löslich in Wasser (823 g·l−1 bei 20 °C)[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Gewinnung und Darstellung
Dimethylzinndichlorid kann durch katalytische Umsetzung von Zinn und Methylchlorid in Gegenwart von Trialkylaminen als Katalysator hergestellt werden.[4]
Auch kann Dimethylzinndichlorid in hoher Ausbeute und Selektivität durch Direktsynthese aus flüssigem Zinn und Methylchlorid in einer Natriumtetrachloroaluminat-Salzschmelze bei 280 °C hergestellt werden. Dabei wird die Reaktion durch Zugabe einer katalytischen Menge Zinndichlorid in Gang gesetzt:[5]
Im ersten Schritt reagiert Methylchlorid zunächst mit SnCl2 unter Bildung von Methylzinntrichlorid, welches dann mit Zinn unter SnCl2-Abspaltung zu Methylzinnchlorid reduziert wird. Im nächsten Schritt bildet sich dann aus diesem durch Reaktion mit einem weiteren Molekül Methylchlorid das Dimethylzinndichlorid:
Als Bruttogleichung ergibt sich:
Die Selektivität wird dabei durch die Menge der Salzschmelze und der Einleitungsgeschwindigkeit der Methylchlorids beeinflusst. Das in einer Nebenreaktion ebenfalls gebildete Trimethylzinnchlorid reagiert mit Methylzinntrichlorid unter Komproportionierung zum Dimethylzinndichlorid. Bei Abwesenheit von Zinn bleibt die Reaktion entsprechend nach der ersten Stufe, der Bildung von Methylzinntrichlorid, stehen.
Eigenschaften
Dimethylzinndichlorid ist ein brennbarer feuchtigkeitsempfindlicher weißer Feststoff, der leicht löslich in Wasser ist.[1] Es hat in Benzol ein Dipolmoment von 4,14 Debye.[6]
Verwendung
Dimethylzinndichlorid wird als Wärmestabilisator in PVC[3] und für die Produktion von Isolierverglasungen mit selektiver Reflexion der Wärmestrahlung[7] verwendet.
Sicherheitshinweise/Toxizität
Dimethylzinndichlorid ist wie viele andere organische Zinnverbindungen als giftig eingestuft und muss daher mit entsprechender Vorsicht gehandhabt werden. Die toxischen Wirkung zielt insbesondere auf die Nieren und das zentrale Nervensystem, in höherer Dosis auch auf Leber, Nebennieren, Thymus, Milz, Harnblase, Hoden und Nebenhoden.[8]
Literatur
- H. Reuter, R. Pawlak: Zinnhalogenverbindungen. III. Neuere Daten zur Kristall- und Molekülstruktur von Dimethylzinndichlorid. In: Zeitschrift für Kristallographie. 216, 2001, S. 56, doi:10.1524/zkri.216.1.56.18994.
Einzelnachweise
- Eintrag zu Dimethylzinndichlorid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 9. Januar 2019. (JavaScript erforderlich)
- Eintrag zu Dimethyltin dichloride im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. August 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ECHA: CLH - Report Proposal for Harmonised Classification and Labelling Based on Regulation (EC) No 1272/2008 (CLP Regulation) - Substance Name: dimethyltin dichloride, DMTC, abgerufen am 18. April 2015.
- Patent US3857868: Preparation of dimethyltin dichloride. Veröffentlicht am 31. Dezember 1974, Erfinder: T. Kugele, R. Witman.
- A. v. Rumohr, W. Sundermeyer, W. Towae: Chemische Reaktionen in Salzschmelzen. XIX. Zur Direktsynthese des Dimethylzinndichlorids, (CH3)2SnCl2. In: Zeitschrift für anorganische und allgemeine Chemie. Band 499, Nr. 4, April 1983, S. 75–80, doi:10.1002/zaac.19834990409.
- Jörg Lorberth, Heinrich Nöth: Dipolmomente einiger Organozinnchloride. In: Chemische Berichte. Band 98, Nr. 3, März 1965, S. 969, doi:10.1002/cber.19650980342.
- Umweltbundesamt: D. Klingmüller, B. Watermann mit Unterstützung des Umweltbundesamtes: TBT – Zinnorganische Verbindungen – Eine wissenschaftliche Bestandsaufnahme, ISSN 0722-186X, abgerufen am 18. April 2015.
- DFG (Hrsg.): The MAK-Collection for Occupational Health and Safety. Wiley-VCH Verlag, Weinheim 2002, ISBN 978-3-527-60041-0, Kapitel Methylzinnverbindungen, S. 3–9, doi:10.1002/3527600418.mb744031metd0056.


