Oxokohlenstoffe
Mit dem Begriff Oxokohlenstoffe werden nach unterschiedlichen Definitionen unterschiedliche Gruppen chemischer Verbindungen bezeichnet.
Der Begriff Oxokohlenstoffe wurde von Robert West für cyclische Verbindungen von miteinander verbundenen Carbonylgruppen, die auch hydratisiert sein können, geprägt.[1][2]
Nach der IUPAC-Definition zählen zu den Oxokohlenstoffen (englisch oxocarbons) alle Verbindungen, die ausschließlich aus Kohlenstoff und Sauerstoff aufgebaut sind.[3] Diese werden im deutschen Sprachgebrauch als Kohlenstoffoxide bezeichnet und umfassen beispielsweise Kohlenstoffmonoxid (CO), Kohlenstoffdioxid (CO2), Kohlenstofftrioxid (CO3), Kohlenstoffsuboxid (C3O2), und Mellitsäureanhydrid (Dodecakohlenstoffnonaoxid, C12O9).
Oxokohlenstoffe nach West
Zu dieser Gruppe gehören die Dreiecksäure, Quadratsäure, Krokonsäure und Rhodizonsäure, die man als Grundkörper dieser Gruppe mit drei bis sechs Carbonylgruppen im Ring und der allgemeinen Formel CnOnH2 (n=3 bis 6) ansehen kann. Außerdem sind eine Reihe von Derivaten, insbesondere Ester und Salze, bekannt.
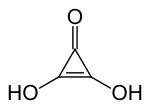 Dreiecksäure
Dreiecksäure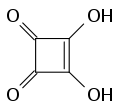 Quadratsäure
Quadratsäure Krokonsäure
Krokonsäure Rhodizonsäure
Rhodizonsäure
Geschichte
Zum ersten Mal gelang es Leopold Gmelin 1825 die Krokonsäure herzustellen, indem er Kaliumcarbonat mit Kohlenstoff in einer eisernen Retorte erhitzte. Hierbei erhielt er als Nebenprodukt eine gelbe Substanz, die er als krokonsaures Kalium mit der Formel K2C5O5 bezeichnete. Nach Zugabe von Schwefelsäure konnte er die freie Krokonsäure isolieren. Außerdem konnte Gmelin noch eine rote Substanz beobachten, die 1837 von J. F. Heller als Kaliumrhodizonat mit der Formel K2C6O6 bezeichnet wurde und aus der er nach Behandlung mit einer Säure die freie Rhodizonsäure erhielt.[4] Justus von Liebig fand einige Jahre später, dass man Kaliumkrokonat und Kaliumrhodizonat über eine Reaktion von Kohlenstoffmonoxid mit Kalium synthetisieren konnte. Die Synthese der Dreiecksäure und Quadratsäure gelang erst ab der Mitte des 20. Jahrhunderts.[5][6]
Herstellung
Neben den historischen Verfahren gibt es heute folgende Synthesemöglichkeiten:
- Dreiecksäure: Reaktion von Dichlorcarben mit Bis-tert-butoxyacetylen über Dreiecksäure-bis-tert-butylester
- Quadratsäure: Dimerisierung von Chlortrifluorethen und anschließender Hydrolyse; intramolekulare Cycloaddition von Hexachlor-1,3-butadien und anschließender Hydrolyse; elektrochemische Tetramerisierung von Kohlenstoffmonoxid
- Rhodizonsäure: Trimerisierung von Glyoxal
Eigenschaften
Die Verbindungen sind kristalline Festkörper, deren Farbe von farblos bis rot mit zunehmender Ringgröße zunimmt. Sie weisen eine hohe Acidität auf, wobei die Quadratsäure die stärkste Säure ist. Die Alkalimetallsalze der Säuren sind an der Luft beständig und in Wasser leicht löslich. Die Oxokohlenstoffe lassen sich mit Oxidationsmitteln wie z. B. Salpetersäure leicht in entsprechende Polyhydroxyverbindungen überführen. So erhält man aus Rhodizonsäure Dodecahydroxycyclohexan und aus Quadratsäure Octahydroxycyclobutan.
Pseudooxokohlenstoffe
Unter Pseudooxokohlenstoffen versteht man Verbindungen, in denen die Sauerstoffatome der Oxokohlenstoffe durch andere Atome, wie Chlor-, Stickstoff- oder Schwefelatome (Thiooxokohlenstoffe) bzw. Atomgruppen ersetzt sind.[7]
Literatur
- Arthur H. Schmidt: Oxokohlenstoffe. In: Chemie in unserer Zeit. 16. Jahrg. 1982, Nr. 2, S. 57–67, doi:10.1002/ciuz.19820160205.
Einzelnachweise
- Robert West, David L. Powell: New Aromatic Anions. III. Molecular Orbital Calculations on Oxygenated Anions, in: J. Am. Chem. Soc., 1963, 85 (17), S. 2577–2579; doi:10.1021/ja00900a010.
- Robert West, Joseph Niu: Oxocarbons and their reactions. In: J. Zabicky (Hrsg.): The Carbonyl Group: Volume 2 (1970), S. 214. doi:10.1002/9780470771228.ch4.
- Eintrag zu oxocarbons. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.O04375 – Version: 2.3.3.
- Joh. Florian Heller: Ueber die Rhodizonsäure, eine neue Oxydationsstufe des Kohlenstoffs, und die Krokonsäure, dann die Salze beider. Prag, 1837 (eingeschränkte Vorschau in der Google-Buchsuche).
- David Eggerding, Robert West: Synthesis and properties of deltic acid (dihydroxycyclopropenone) and the deltate ion. In: J. American Chemical Society, 1976, 98, S. 3641–3644. doi:10.1021/ja00428a043.
- J. D. Park, S. Cohen, J. R. Lacher: Hydrolysis Reactions of Halogenated Cyclobutene Ethers: Synthesis of Diketocyclobutenediol. In: J. Am. Chem. Soc., 1962, 84, S. 2919–2922 doi:10.1021/ja00874a015.
- Gunther Seitz: Pseudooxokohlenstoffe. In: Nachr. Chem. Tech. Lab. Band 28, Nr. 11, 1980, S. 804–807, doi:10.1002/nadc.19800281108.