Polyferrocene
Polyferrocene sind eine Klasse von Ferrocen enthaltenden Polymeren, die sich in mehrere Unterklassen einteilen lässt. Ferrocen bietet als Baustein der makromolekularen Chemie viele Vorteile gegenüber reinen Kohlenwasserstoffen. Es ist temperaturstabil, resistent gegen Säuren und Laugen, ist beständig an Luft und ist einfach aus preiswerten Rohmaterialien herstellbar. Durch die vielfältigen Variationsmöglichkeiten der Substitution am Ferrocen-Grundkörper ergibt sich die Möglichkeit zur Herstellung von Polymeren mit interessanten elektronischen und photonischen Eigenschaften. Viele Polyferrocene sind relativ leicht zugänglich. Poly(1,1’-ferrocen-silan)e etwa sind durch ringöffnende Polymerisation herstellbar und weisen eine Vielzahl interessanter Materialcharakteristika auf, etwa einen hohen Brechungsindex oder Halbleitereigenschaften.
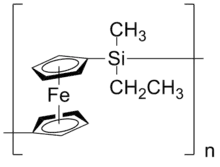
Nomenklatur und Einteilung
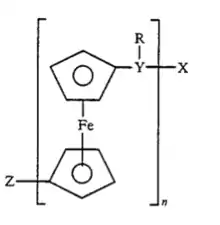
Polyferrocene lassen sich in drei Unterklassen einteilen. Die Verbindungen der ersten Unterklasse bestehen aus 1,1’-Ferrocenfragmenten, die über verschiedene Spacer verbunden sind. Dazu gehören Poly(1,1’-ferrocen-alkylen)e, die aus Ferrocen und Alkyeinheiten aufgebaut sind und Poly(1,1’-ferrocen-arylen)e, bei denen 1,1’-Fragmente durch Spacer wie Aryleinheiten verbunden sind. Ebenso existieren Polyferrocene, bei den die Cyclopentadienlyleinheiten über Phosphan-, Silan- oder Schwefelspacer verbunden sind. Diese nennt man je nach Heteroatom Poly(1,1’-ferrocen-phosphan)e, Poly(1,1’-ferrocen-silan)e oder Poly(1,1’-ferrocen-sulfid)e. Daneben existieren Polyferrocene mit Brücken, die von weiteren Haupt- oder Nebengruppenelementen wie etwa Gallium, Selen oder Zinn gebildet werden.[1]
Sind die Cyclopentadienylliganden der Ferroceneinheiten direkt miteinander verbunden, bilden diese eine weitere Unterklasse; die entsprechenden Polymetallocene werden als Poly(1,1’-ferrocen)e bezeichnet.[1]
In Molekülen der dritten Unterklasse ist der Cyclopentadienylrest mit polymerisierbaren Seitenketten wie etwa 1,3-Butadien substituiert. Diese Seitenketten können radikalisch oder anionisch polymerisiert oder mit anderen Monomeren copolymerisiert werden. In diesen Fällen entstehen Polymere wie zum Beispiel Poly(1-ferrocen-1,3-butadien), bei denen die Ferroceneinheit als Seitenkette aufgefasst werden kann.[2] Allerdings ist diese Struktur nicht auf Polymere mit organischem backbone beschränkt, so dass auch anorganische Polymere mit Ferrocenseitenketten bekannt sind und über interessante Eigenschaften verfügen.[3]
Geschichte
.JPG.webp)
Schon kurz nach der Entdeckung des Ferrocens im Jahr 1951[4] wurde versucht, die synthetischen und strukturellen Möglichkeiten des Moleküls für Polymerisationsreaktionen zu nutzen. Die hohe Temperaturbeständigkeit von Ferrocen bot die Möglichkeit zur Entwicklung hochtemperaturbeständiger Polymere, die Redoxeigenschaften schienen einen Einsatz als Katalysator zu erlauben. Weiterhin zeigte sich ein technologisches Potenzial in Bereichen wie dem Strahlenschutz als UV-Absorber oder als organische Halbleiter.[5]
Die erste Synthese eines Polyferrocens gelang bereits 1955.[6] In den 1960er Jahren gelang die Synthese von Poly(1,1’-ferrocen)en durch die Kupplung von 1,1’-Diiodoferrocen mit Magnesium in guten Ausbeuten. Die Kondensation von Ferrocen mit Aldehyden gelang im Jahr 1963.[7]
Im Jahr 1992 berichtete Thomas B. Rauchfuss über die Darstellung von Polyferrocenen durch ringöffnende Polymerisation von Ferrocenophanen.[8] Diese Methode fand eine breite Anwendung in der Darstellung von Polyferrocenen, die erhaltenen Polymere weisen hohe molare Massen auf, die sich zu Filmen weiterverarbeiten lassen. Neben den von Rauchfuss eingesetzten Persulfid-Brücken eignet sich eine breite Vielfalt von organischen und anorganischen Brücken in Ferrocenophenen zur Darstellung der Polyferrocene.
2016 berichtete eine Gruppe vom Imperial College London von der Darstellung oligomerer Ferrocenringe mit Ringgrößen zwischen 5 und 9 Ferroceneinheiten.[9]
Herstellung

Ferrocen verhält sich auf Grund der Aromatizität der Cyclopentadienylliganden in vielen Reaktionen wie ein herkömmliches aromatisches System. Eine wichtige Reaktion zur Funktionalisierung des Ferrocens ist die elektrophile aromatische Substitution, wobei das Vorhandensein von zwei Ringen eine einfachere Mehrfachsubstitution erlaubt. Durch die Modifikation der Ferroceneinheit mit weiteren Substituenten, etwa Alkylketten, lassen sich zum Beispiel die Lösungseigenschaften des Polymers variieren.
Poly(1,1’-ferrocen)e
Poly(1,1’-ferrocen)e werden durch verschiedene Synthesen hergestellt. Die erste Synthese beruhte auf der Einwirkung von Di-tert-butylperoxid auf Ferrocen. Die Produkte mit einer molare Masse von etwa 7000 g/mol enthielten nicht nur Polymetallocene, sondern auch alkyl- oder etherverbrückte Einheiten.[10] Die radikalische Darstellung über Dilithiumferrocene lieferte ebenfalls keine einheitlichen Produkte mit ausreichender Kettenlänge.[10]
Poly(1,1’-ferrocene-alkylen)e
Ähnlich der Reaktion der Phenoplaste lässt sich Methylcarbinolferrocen mit dem aus Formaldehyd und Dimethylamin herstellbaren N,N-Dimethylaminomethylferrocen in Gegenwart von Zinkchlorid und Chlorwasserstoff zu Methylenverbrückten Poly(1,1’-ferrocene-methylen)en polymerisieren.[1] Die erhaltenen Polymere sind jedoch nur von relativ geringer Kettenlänge.
Besser verläuft die Herstellung über ringöffnende Polymerisation von Ferrocenophanen, auch ansa-Ferrocene genannt. Ein ethylenverbrücktes Ferrocenophan liefert etwa Poly(1,1´-ferrocen-ethylen)en.[11] Die treibende Kraft der Polymerisation ist die Ringspannung, die mit steigendem Kippwinkel der verbrückten Cyclopentadienyleinheiten größer wird.
Poly(1,1’-ferrocen-arylen)e
Die erste Herstellung der Poly(1,1’-ferrocen-arylen)e erfolgte über Polyrekombination, bei der das Kettenwachstum über den anfänglichen Initiatorzerfall mit Übertragung der Radikalfunktion auf das Oligomer und anschließender Rekombination erfolgt.[1] Die so erhaltenen Polymere wiesen jedoch nur geringe Kettenlängen auf. Erfolgreicher verlief die Polymerisation über die Darstellung eines 1,8-Dicylopentadienylnaphthalins, das nach Überführung in das Dianion mit Eisen(II)-chlorid polymerisiert werden konnte.[1]
Poly(1,1’-ferrocen-silan)e und andere heteroatomverbrückte Polyferrocene
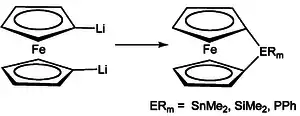
Die Herstellung kann über verschiedene Methoden wie die ringöffnende Polymerisation von Ferrocenophanen erfolgen.[12][13] Die Ferrocenophane sind durch Reaktion von Dilithiumferrocen mit zum Beispiel Dimethyldichlorsilan zu gewinnen.
Poly(1,1’-ferrocen-phosphan)e lassen sich durch Polykondensation von 1,1’-Dilithiumferrocen mit Dichlorphenylphosphan gewinnen.[1] Die so erhaltenen Poly(1,1’-ferrocen-phosphan)e sind temperaturbeständig bis 350 °C. Phosphorüberbrückte Ferrocenophane lassen sich durch thermisch oder anionisch induzierte ringöffnenden Polymerisation zu Homo- oder gemischten Blockcopolymeren polymerisieren. Dadurch sind etwa Poly(1,1’-ferrocen-phosphan-sulfid)e zugänglich.[1]
Poly(1-ferrocen-alken)e
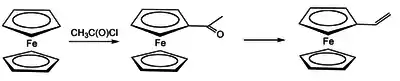
Eine wichtige Ausgangsverbindung für die Herstellung von Poly(1-ferrocen-alken)e ist Vinylferrocen. Dieses lässt sich durch Reduktion von Acetylcyclopentadienyl-Cyclopentadienyleisen mittels Lithiumaluminiumhydrid über eine Methylcarbinolzwischenstufe, die thermisch zum Vinylderivat des Ferrocens abgebaut wurde, synthetisieren. Das Vinylferrocen lässt sich einfach homo- oder mit anderen Vinylmonomeren wie Styrol oder Methacrylsäuremethylester copolymerisieren.[6]
Anwendungen
Die Polyferrocene finden wissenschaftlich Anwendungen als hoch lichtbrechende Polymere, etwa als Antireflexbeschichtung oder bei Leuchtdioden.[14] Polyferrocene sind nach Dotierung mit Iod hoch leitfähig.[15] Weiterhin lässt sich Ferrocen reversibel zum Ferrocinium-Ion oxidieren. Alle genannten Anwendungen befinden sich allerdings noch im Versuchsstadium und haben trotz vielversprechender Ansätze noch keinen Eingang in die Technik gefunden.
Beschichtungen
Satelliten laden sich durch den Beschuss mit geladenen Teilchen des Sonnenwinds auf. Durch die Aufladung kann es zu einer Lichtbogenentladung kommen, welche die Funktion des Satelliten durch magnetische Störungen und Materialversagen erheblich beeinträchtigen kann. Um diese Beeinträchtigungen zu vermeiden, wurden Beschichtungen der elektrisch schwach- oder nichtleitenden Kunststoffkomponenten mit dünnen Filmen aus Poly(1,1’-ferrocen-silan)en untersucht. Diese leiten die durch die Bestrahlung entstehende Ladung ab und könnten so den Satelliten vor Überschlägen schützen.[15]
Polymere mit hohem Brechungsindex
Poly(1,1’-ferrocen-silan)e, Poly(1,1’-ferrocen-phospan)e und Polyferrocene mit Phenyl-Seitenketten sind Polymere mit ungewöhnlich hohem Brechungsindex, wobei Werte im Brechungsindex von bis zu 1,74 erreicht werden. Die Polyferrocene weisen gute Filmbildungsfähigkeit auf und gelten als Kandidaten für photonische Bauelemente.[16]
Plasma-unterstütztes reaktives Ionenätzen
Poly(ferrocen-dimethylsilan)e (PFS) wurden als Barrierematerial im plasma-unterstützten reaktiven Ionenätzen eingesetzt. Aufgrund der Anwesenheit von Eisen und Silicium in der Hauptkette erwies sich das Polymer als relativ stabil im Vergleich zu rein organischen Polymeren. Während des Ätzens wurde eine dünne Eisen und Silizium enthaltende Oxidschicht an der Oberfläche des Poly(ferrocen-dimethylsilan)s gebildet.[17]
Literatur
- Ian Manners: Polymers and the Periodic Table: Recent Developments in Inorganic Polymer Science. In: Angewandte Chemie International Edition in English. 35, 1996, S. 1602, doi:10.1002/anie.199616021.
- Jürgen Falbe, Manfred Regitz (Hrsg.): Römpp-Lexikon Chemie, 9.te Auflage, Bd. 5, PI-S, 1999, ISBN 3-13-735010-7, S. 3449–3455.
Weblinks
Einzelnachweise
- Jürgen Falbe, Manfred Regitz (Hrsg.): Römpp-Lexikon Chemie, 9.te Auflage, Bd. 5, PI-S, 1999, ISBN 3-13-735010-7, S. 3449–3455.
- Dennis C. Van Landuyt, Samuel F. Reed: Polymerization studies on 1-ferrocenyl-1,3-butadiene. In: Journal of Polymer Science Part A-1: Polymer Chemistry. 9, S. 523, doi:10.1002/pol.1971.150090224.
- Rudolf Pietschnig: Polymers with pendant ferrocenes. In: Chemical Society Reviews 45, 2016, S. 5216, doi:10.1039/C6CS00196C.
- T. J. Kealy, P. L. Pauson: A New Type of Organo-Iron Compound. In: Nature. 168, 1951, S. 1039, doi:10.1038/1681039b0.
- Eberhard W. Neuse, Harold Rosenberg: Metallocene Polymers. In: Journal of Macromolecular Science, Part C. 4, 2007, S. 1, doi:10.1080/15321797008080022.
- F. S. Arimoto, A. C. Haven: Derivatives of Dicyclopentadienyliron . In: Journal of the American Chemical Society. 77, 1955, S. 6295, doi:10.1021/ja01628a068.
- Eberhard W. Neuse: Ferrocene-containing Polymers : Polycondensation of Ferrocene with Aldehydes. In: Nature. 204, 1964, S. 179, doi:10.1038/204179a0.
- Paul F. Brandt, Thomas B. Rauchfuss: Polyferrocenylene persulfides. In: Journal of the American Chemical Society. 114, 1992, S. 1926, doi:10.1021/ja00031a083.
- Michael S. Inkpen, Stefan Scheerer, Michael Linseis, Andrew J. P. White, Rainer F. Winter, Tim Albrecht, Nicholas J. Long: Oligomeric ferrocene rings. In: Nature Chemistry. 8, 2016, S. 825–830, doi:10.1038/nchem.2553.
- Eberhard W. Neuse, Ronald K. Crossland: Metallocene polymers XIX. Polyferrocenylenes. In: Journal of Organometallic Chemistry. 7, 1967, S. 344, doi:10.1016/S0022-328X(00)91087-8.
- Ian Manners: Polymers and the Periodic Table: Recent Developments in Inorganic Polymer Science. In: Angewandte Chemie International Edition in English. 35, 1996, S. 1602, doi:10.1002/anie.199616021.
- Harry R. Allcock: Inorganic-Organic Polymers. In: Advanced Materials. 6, 1994, S. 106, doi:10.1002/adma.19940060203.
- Ian Manners: Ring-opening polymerization of metallocenophanes. In: Advanced Materials. 6, 1994, S. 68, doi:10.1002/adma.19940060115.
- Ian Manners: Polyferrocenylsilanes: metallopolymers for electronic and photonic applications. In: Journal of Optics A: Pure and Applied Optics. 4, 2002, S. S221, doi:10.1088/1464-4258/4/6/356.
- R. Resendes, A. Berenbaum, G. Stojevic, F. Jäkle, A. Bartole, F. Zamanian, I. Manners: Application of ring-opened poly (ferrocene) s as protective charge dissipation coatings for dielectrics. In: Advanced Materials, 12(5), (2000), S. 327–330.
- Vasilios Bellas, Matthias Rehahn: Polyferrocenylsilane-Based Polymer Systems. In: Angewandte Chemie International Edition. 46, 2007, S. 5082, doi:10.1002/anie.200604420.
- Rob G. H. Lammertink, Mark A. Hempenius, Vanessa Z.-H. Chan, Edwin L. Thomas, G. Julius Vancso: Poly(ferrocenyldimethylsilanes) for Reactive Ion Etch Barrier Applications. In: Chemistry of Materials. 13, 2001, S. 429, doi:10.1021/cm001052q.