Tris(trimethylsilyl)phosphan
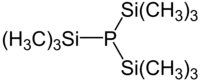
Tris(trimethylsilyl)phosphan ist ein tertiäres Phosphan mit der Summenformel C9H27PSi3. Es wird in Laboratorien anstelle des gasförmigen und äußerst toxischen Monophosphans (PH3) zur Synthese von verschiedensten Phosphorverbindungen benutzt.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Tris(trimethylsilyl)phosphan | |||||||||||||||
| Andere Namen |
Tris(trimethylsilyl)phosphin | |||||||||||||||
| Summenformel | C9H27PSi3 | |||||||||||||||
| Kurzbeschreibung |
farbloser Feststoff oder farblose Flüssigkeit mit stechendem Geruch[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 250,54 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest oder flüssig | |||||||||||||||
| Dichte |
0,86 g·cm−3[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt | ||||||||||||||||
| Löslichkeit |
nahezu unlöslich in Wasser[2] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Bei 20 °C ist die Verbindung fest und kann sich an der Luft selbst entzünden. Es wird daher mit Schutzgas gearbeitet. Wie bei vielen anderen Phosphanen ist auch bei dieser Verbindung der Geruch nach Fäulnis sehr unangenehm.
Synthese
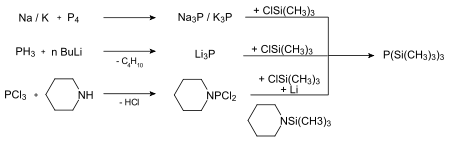
Prinzipiell gibt es drei Möglichkeiten Tris(trimethylsilyl)phosphan herzustellen.
Die ersten beiden Synthesewege sind zwar technisch durchführbar, jedoch weniger für den Laboralltag geeignet.
Niecke und Westermann[4] konnten ein alternatives und leicht durchführbares Verfahren etablieren, bei dem das geschützte Phosphan in guten Ausbeuten zugänglich ist. Es ist auch durch die Umsetzung von Trimethylchlorsilan, Phosphortrichlorid und Magnesium in Tetrahydrofuran zugänglich.[5]
Eigenschaften
Sehr häufig dient Tris(trimethylsilyl)phosphan als Synthesebaustein für die Erweiterung bestehender Moleküle um eine Phosphangruppe. Die Trimethylsilylgruppen dienen dabei nur vorübergehend zum Schutz und erhöhen die Nukleophilie des Phosphors. Die leichte Abspaltung der Schutzgruppen ist durch die hohe Oxophilie (Affinität von Silizium zu Sauerstoff) gewährleistet.
So kann man beispielsweise aus Tris(trimethylsilyl)phosphan das Cyaphid, ein isoelektronisches Phosphoranalogon von Cyanid, erhalten. Bei dieser Reaktion wird Tris(trimethylsilyl)phosphan mit Acylhalogeniden und anschließender β-Eliminierung zum Organyl-cyaphid umgesetzt.[6]
Übergangsmetallkomplexe
Metallcarbonyle können als Ausgangsmoleküle für größere Metallatomcluster dienen. Phosphanverbindungen haben sich hierbei als Brückenbildner hervorgetan. Die Anbindung von Tris(trimethylsilyl)phosphan ermöglicht den Zugang zu PH3-Clustern, die beispielsweise durch weitere thermische Behandlung zu Clustern mit drei oder mehr Metallatomen umgesetzt werden können. Nur ein Beispiel von vielen ist die Reaktion von Dirheniumdekacarbonyl mit Tris(trimethylsilyl)phosphan, welche nach anschließender Methanolyse (Umwandlung der Trimethylsilylgruppen in Wasserstoff) Re2(CO)9PH3 ergibt. Thermische oder photochemische Weiterbehandlung ergibt Re2(µ-H)(µ3-PHRe(CO)5)(CO)8[7], in dem der Phosphor als µ3-P-Brücke fungiert und somit drei Rheniumatome bindet.
Die Wasserstoffatome des PH3-Liganden können auch schrittweise nach Deprotonierung gegen Metallcarbonylhalogenide getauscht werden und die außerdem erhaltenen µ-H-Brücken mit ClAuPPh3 isolobal getauscht werden. So gelang 2001 die Synthese von Re2(μ-AuPPh3)(μ4-P(Fe(cis-Cp)CO)2(μ-CO))(CO)8[8], einem Cluster mit μ4-P-Brücke.
Setzt man Münzmetallhalogenide mit Tris(trimethylsilyl)phosphan um, so entstehen hoch aggregierte Metallcluster mit P3−-Brücken. Ein ausgewähltes Beispiel ist die Reaktion mit CuCl, bei der der Cluster [Cu96P30{P(SiMe)3}6(PEt3)18] entsteht.[9]
Einzelnachweise
- Datenblatt Tris(trimethylsilyl)phosphan bei AlfaAesar, abgerufen am 10. März 2010 (PDF) (JavaScript erforderlich).
- Datenblatt Tris(trimethylsilyl)phosphine (PDF) bei Strem, abgerufen am 25. Dezember 2012.
- Datenblatt Tris(trimethylsilyl)phosphine bei Sigma-Aldrich, abgerufen am 25. April 2011 (PDF).
- Niecke, Westermann: Ein einfaches Verfahren zur Herstellung von Tris(trimethylsilyl)phosphan, in: Synthesis, 1988, S. 330; doi:10.1055/s-1988-27560.
- H. Schumann, L. Rösch: Darstellung und Schwingungsspektren von Trimethylsilyl-, Trimethylgermyl- und Trimethylstannyl-tert-butylphosphinen, in: Chem. Ber., 1974, 107, S. 854–868; doi:10.1002/cber.19741070312.
- M. Regitz: Phosphaalkynes: new building blocks in synthetic chemistry, in: Chem. Rev., 1990, 90, S. 191–213; doi:10.1021/cr00099a007.
- H.-J. Haupt, O. Krampe, U. Flörke: Darstellung und Molekülstrukturen von oligofunktionalen Dirheniumcarbonylderivaten aus Dirheniumnonacarbonylphosphan, in: Z. anorg. allg. Chem., 1996, 622, S. 807–812; doi:10.1002/zaac.19966220510.
- P. Haferkamp: Zur Metallerweiterung von Zweikernkomplexen der Gruppe 7 auf der Grundlage von PH-aciden Liganden: Synthese, Strukturen, Eigenschaften und Katalyse; Dissertation Universität Paderborn 2001.
- Fenske et al.: Neue Phosphido-verbrückte Kupfercluster, in: Angew. Chem., 1993, 105, S. 257–261; doi:10.1002/ange.19931050214.
Literatur
- Louis D. Quin: A Guide to Organophosphorus Chemistry. Wiley-Interscience, 2000, ISBN 0-471-31824-8.
- Christoph Elschenbroich, A. Salzer: Organometallchemie. Teubner Taschenbücher Chemie, 1990, ISBN 3-519-23501-3.