Magnesiumbromid
Magnesiumbromid ist das Magnesiumsalz der Bromwasserstoffsäure (HBr). Es zählt zur Gruppe der Bromide und hat die Summenformel MgBr2.
| Kristallstruktur | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
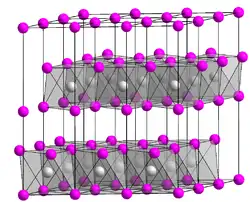 | ||||||||||
| _ Mg2+ _ Br− | ||||||||||
| Allgemeines | ||||||||||
| Name | Magnesiumbromid | |||||||||
| Andere Namen | ||||||||||
| Verhältnisformel | MgBr2 | |||||||||
| Kurzbeschreibung |
farbloser Feststoff[2] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 184,11 g·mol−1 | |||||||||
| Aggregatzustand |
fest | |||||||||
| Dichte |
3,72 g·cm−3 (25 °C)[3] | |||||||||
| Schmelzpunkt | ||||||||||
| Löslichkeit |
gut in Wasser (1015 g·l−1 bei 20 °C)[2] | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||
Vorkommen
Magnesiumbromid kommt natürlich in Kalilagerstätten (Bromide kommen in Kalisalzen etwa im Verhältnis von 1:300 zu den analogen Chloriden vor) und im Meerwasser (in einer Konzentration von etwa 70 g/m³) vor.[4]
Gewinnung und Darstellung
Es existieren einige Möglichkeiten zur Herstellung von Magnesiumbromid. Zum einen kann Magnesiumbromid durch Reaktion einer Magnesiumhydroxidlösung (gewonnen aus Magnesiumchlorid) mit Bromwasserstoff gewonnen werden.
Eine weitere Möglichkeit ist durch die Darstellungen aus den Elementen gegeben. Diese Reaktion wird in wasserfreiem Diethylether durchgeführt, da das direkte Zutropfen elementaren Broms auf metallisches Magnesium eine zu heftige Reaktion verursachen würde.
Eigenschaften
Magnesiumbromid ist ein farbloses, hygroskopisches Pulver und tritt auch als Hexahydrat auf, welches bei 165 °C zu wasserfreiem Magnesiumbromid dehydratisiert. Es kristallisiert im trigonalen Polytyp 2H von Cadmiumiodid mit den Gitterparametern a = 4,154 Å und c = 6,862 Å.[5]
Verwendung
Magnesiumbromid kann zur Herstellung von Brom aus bromidhaltigen Laugen verwendet werden.
In der organischen Synthese wird die Verbindung als Lewis-Säure-Katalysator eingesetzt, wobei eine Stabilisierung von Übergangszuständen bei Additionsreaktionen erfolgt.[6][7] Weiterhin können Alkylbromide aus den Tosylaten primärer und sekundärer Alkohole erhalten werden.[6]
Einzelnachweise
- Eintrag zu MAGNESIUM BROMIDE in der CosIng-Datenbank der EU-Kommission, abgerufen am 18. September 2021.
- Datenblatt Magnesium bromide, anhydrous (PDF) bei Strem, abgerufen am 25. Dezember 2012.
- Datenblatt Magnesium bromide bei Sigma-Aldrich, abgerufen am 9. April 2011 (PDF).
- Brom bei Seilnacht.
- M.A. Brogan, A.J. Blake, C. Wilson, D.H. Gregory: Magnesium diiodide, MgI2. In: Acta Crystallographica, C59, 2003, S. i136–i138, doi:10.1107/S0108270103025769.
- Eintrag zu Magnesiumbromid. In: Römpp Online. Georg Thieme Verlag, abgerufen am 12. September 2017.
- Yuji Kazuta, Hiroshi Abe, Akira Matsuda, Satoshi Shuto: Highly Stereoselective Grignard Addition to Cis-Substituted C-Cyclopropylaldonitrones. The Bisected s-Trans Transition State Can Be Stabilized Effectively by the Lewis Acid-Coordination in J. Org. Chem. 69 (2004) 9143–9150, doi:10.1021/jo048637e.
Literatur
- Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band II, Ferdinand Enke, Stuttgart 1978, ISBN 3-432-87813-3, S. 905–907.
