Oseltamivir
Oseltamivir ist ein Arzneistoff aus der Gruppe der Neuraminidase-Hemmer, der für die Therapie der Virusgrippe (Influenza) sowie zur Postexpositionsprophylaxe (Vorbeugung nach möglichem Kontakt mit einem Infizierten) bei Kindern ab einem Jahr und Erwachsenen zugelassen ist. Oseltamivir wird neben Zanamivir und Amantadin als Mittel gegen die echte, durch Influenza-A- oder B-Viren ausgelöste Grippe angeboten. Es soll virostatisch wirken, das heißt, Viren an der Vermehrung im Körper hindern; es kann sie jedoch nicht eliminieren oder inaktivieren. Der Einsatz gegen die Vogelgrippe H5N1 wurde von der WHO empfohlen.[2] 2012 und 2014 wurden nach Untersuchungen der Cochrane Collaboration Zweifel an der Wirksamkeit und Sicherheit von Oseltamivir laut.[3] Die WHO hat Oseltamivir daher 2017 von „wesentlich“ (englisch essential) auf nur noch „ergänzend“ (englisch complementary) herabgestuft.[4]
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Freiname | Oseltamivir | |||||||||||||||
| Andere Namen |
(3R,4R,5S)-4-Acetamido-5-amino-3-(1-ethylpropoxy)cyclohex-1-en-1-carbonsäureethylester | |||||||||||||||
| Summenformel | C16H28N2O4 | |||||||||||||||
| Kurzbeschreibung |
geruchloser Feststoff (Phosphat)[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||
| ATC-Code |
J05AH02 | |||||||||||||||
| Wirkstoffklasse | ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 312,40 g·mol−1 (Oseltamivir) | |||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||
| Schmelzpunkt |
197–204 °C (Phosphat)[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Geschichte
Die Entwicklung von Grippemitteln begann in den frühen 1990er Jahren. Wissenschaftler des Parkville Campus für Pharmazie an der Monash University im australischen Melbourne präsentierten am 14. Oktober 1992 auf einem Infektiologiekongress in Los Angeles einen Vorläufer von Zanamivir ohne Arzneimittelzulassung als Mittel gegen Grippe an Mäusen. Dieser Wirkstoff musste jedoch über die Lunge inhaliert werden, wo die Krankheit auch meist ausbricht. Norbert Bischofberger von der Biotechnologie-Firma Gilead Sciences in Foster City bei San Francisco versuchte nun ein Medikament zu entwickeln, das nach dem gleichen Prinzip wirkt, aber in Tablettenform verabreicht werden kann. Nachdem dies gelang, begann eine Zusammenarbeit mit der Firma Roche. Im November 1996 begannen die klinischen Studien zur Arzneimittelzulassung.
Im September 1999 wurde Oseltamivir erstmals in der Schweiz zugelassen. In der Europäischen Union wurde im Jahr 2000 der Antrag auf Arzneimittelzulassung von Hoffmann-La Roche wieder zurückgezogen, weil Mitglieder des Europäischen Arzneimittelausschusses Zweifel am Beleg des Nutzens hatten. Roche wollte Studiendaten nachreichen.[5]
Im Dezember 2000 erhielt Oseltamivir als Wirkstoff gegen Grippe die amtliche Arzneimittelzulassung in den USA und in Japan, anschließend im Juni 2002 auch in der Europäischen Union.
Die Zulassung war zunächst eingeschränkt: Zur Grippevorbeugung durfte es erst bei Patienten ab 13 Jahren eingesetzt werden. Inzwischen wurde diese Einschränkung aufgehoben und auch Kindern ab einem Jahr darf Oseltamivir zur Prävention verabreicht werden. Der ergänzende Zulassungsantrag stützte sich auf Ergebnisse einer klinischen Studie über die häusliche Grippebehandlung mit dem Wirkstoff. Die Studie, an der über 1000 Patienten – Erwachsene und Kinder – teilnahmen, hatte ergeben, dass Oseltamivir einer Grippeinfektion weiterer Personen im selben Haushalt vorbeugt. Die Schutzwirkung bei Kindern zwischen 1 und 12 Jahren war dabei ebenso gut wie in den übrigen Altersgruppen.
Im Jahr 2006 steigerte Roche die Verkäufe von Tamiflu (Handelsname) gegenüber dem Vorjahr um 68 % auf 2,6 Milliarden Schweizer Franken. Tamiflu war damit im Jahr 2006 auf dem vierten Platz der umsatzstärksten Medikamente von Roche (2005: Platz 6).[6] Im Jahr 2008 sank der Umsatz von Tamiflu auf 278 Millionen Franken pro Quartal[7] und im ersten Halbjahr 2011 wurden mit Tamiflu 262 Millionen Franken und im ersten Halbjahr 2018 wurden 320 Millionen Franken umgesetzt.[8][9]
Wirksamkeit
Die Wirksamkeit von Oseltamivir ist gering. Eine Meta-Analyse der Cochrane Collaboration kam Anfang 2012 unter anderem zu dem Ergebnis, dass die Substanz die Fortdauer der Grippesymptome nur um 21 Stunden verkürze und keinen Einfluss habe auf die Häufigkeit, mit der Erkrankte in ein Krankenhaus aufgenommen werden.[10][11][12] Eine Metaanalyse der Cochrane Collaboration von 2014 fand bei einer Behandlung mit Oseltamivir bei Erwachsenen eine Verkürzung der Erkrankungsdauer von 7 auf 6,3 Tage.[3] Jedoch hatte Oseltamivir keinen Einfluss auf die Häufigkeit schwerer Verlaufsformen wie Pneumonie oder Bronchitis und wies unerwünschte Arzneimittelwirkungen wie Übelkeit, Erbrechen sowie bei prophylaktischer Einnahme Kopfschmerzen, psychiatrische und nierenschädigende Effekte auf. Insbesondere konnte die Einnahme von Oseltamivir nicht den Anteil der Patienten reduzieren, die stationär ins Krankenhaus aufgenommen werden mussten.[3] Weiterhin verwiesen sie auf psychische und neurologische Störungen, die in Studien auftraten, aber nicht veröffentlicht worden waren. Daraus zogen die Forscher den Schluss, dass Oseltamivir weniger wirksam ist und schwerere Nebenwirkungen hat als vom Hersteller behauptet.[13]
Ein im Januar 2006 in The Lancet publizierter systematischer Bericht, der auf zwei bereits 1999 und 2004 erschienenen Cochrane Reviews (systematischen Übersichtsarbeiten)[14] zur Prävention und Therapie der Influenza basiert, fasste die Evidenz der antiviralen Therapie zusammen. Im Wesentlichen bestätigten die Autoren Jefferson et al., dass Neuraminidasehemmer eine Infektion mit Influenza nicht verhindern, jedoch den Verlauf lindern können. Dies gilt nicht für die influenzaähnliche Erkrankung, das heißt die Situation, in der eine Virustestung nicht vorliegt und weitere Viren als Verursacher in Frage kommen. Das Präparat Oseltamivir vermindere zudem die Wahrscheinlichkeit einer weiteren Ausbreitung der Influenza im häuslichen Umfeld. Dies wurde durch eine Verminderung der Virusausscheidung über die Nase erklärt, die vor allem für die Weitergabe der Infektion verantwortlich sei. Allerdings komme es nicht zu einer völligen Eliminierung der Virusbesiedlung in der Nase.
Die Autoren gingen daher davon aus, dass der alleinige Einsatz von Neuraminidasehemmern in einer Pandemie aufgrund der in einer solchen Situation sehr viel höheren Viruslast nicht ausreichend sein würde, um eine Ausbreitung zu kontrollieren. Vielmehr könnte eine zu optimistische Einschätzung der Wirksamkeit von Neuraminidasehemmern zu einem erhöhten Risikoverhalten und somit sogar zu einer Förderung der Virusausbreitung führen. Der Einsatz von Neuraminidasehemmern während einer Influenza-Epidemie sei daher nur bei zusätzlichen Schutzmaßnahmen wie Isolation oder Schutzkleidung erfolgversprechend. Der routinemäßige Einsatz von Neuraminidasehemmern in üblichen „Grippewellen“ wurde wegen der fehlenden Wirkung bei den grippeähnlichen Erkrankungen nicht empfohlen. Von Amantadin und Rimantadin wurde wegen des ungünstigen Nebenwirkungsprofils und der Resistenzentwicklung abgeraten. Auch für Schwangere und stillende Mütter scheint Oseltamivir ein vertretbares Mittel zu sein.[15] Nach einer neuen Studie hat die FDA entschieden, dass Tamiflu (Oseltamivir) auch Säuglingen verabreicht werden darf.[16]
Herstellung
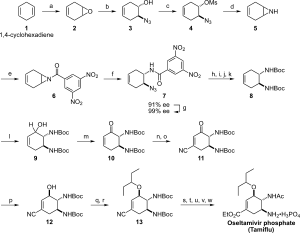
Der Ausgangsstoff für die Herstellung von Oseltamivir ist Shikimisäure in der natürlichen (3R,4S,5R)-Konfiguration. Diese wird heute vor allem aus einem gentechnologisch erzeugten, speziellen Stamm von Escherichia coli–Bakterien gewonnen, kann aber auch aus echtem Sternanis extrahiert werden. 30 kg Anis ergeben ungefähr 1 kg Shikimisäure. Die E. coli–Bakterien produzieren Shikimisäure, wenn sie mit Glucose „überfüttert“ werden. Der extrahierte Ausgangsstoff wird anschließend gefiltert und getrocknet. In der mehrstufigen Synthese treten u. a. hochexplosive Azide als Zwischenprodukte auf. Die Herstellung des Oseltamivir aus dem Ausgangsstoff ist sehr aufwändig.[17]
Eine Arbeitsgruppe der Universität Tokyo, darunter Masakatsu Shibasaki, konnten Oseltamivir im Jahr 2006 auch aus einer gebräuchlichen Laborchemikalie, 1,4-Cyclohexadien, synthetisieren.[18]
In den folgenden Jahren wurden weitere – auch stereospezifische – Synthesewege entwickelt.[19][20][21][22]
Für die letztgenannte Synthese[22] nahm die Arbeitsgruppe von E. Corey keinen Patentschutz in Anspruch, um eine Produktion für jedermann zu ermöglichen.[23]
Wirkungsweise
Der Wirkstoff Oseltamivir wird nach oraler Einnahme zu mehr als 75 % rasch im Magen-Darm-Trakt vom Organismus in das Blut aufgenommen und nahezu vollständig durch spezielle Leberenzyme (hepatische Esterasen) in das aktive Stoffwechselprodukt (Metabolit) Oseltamivircarboxylat umgewandelt. Dieser Wirkstoff hemmt gezielt (selektiv) die Neuraminidasen von Influenzaviren. Diese Neuraminidasen sind Glykoproteine auf der Oberfläche eines Virions (ein Virus, das noch nicht in eine Zelle eingedrungen ist, oder nach dem Eintritt durch die Replikation neu entstandene Viren, die anschließend als Tochtervirionen diese Zelle wieder verlassen). Sie dienen den nach der Replikation neu entstandenen Viren dazu, Sialinsäure aufzulösen, welche die Wirtszellen bedeckt. Die durch den Metaboliten gehemmten, viruseigenen Neuraminidasen besitzen normalerweise eine enzymatische Aktivität, die für die Freisetzung von neu gebildeten Viruspartikeln aus infizierten Zellen entscheidend ist und damit auch für die weitere Verbreitung der infektiösen Viren im Körper.
Viren verändern mit jeder neuen Generation das Aussehen und die genetische Sequenz ihres Neuraminidase-Enzyms, ein Spalt dieses Enzyms bleibt jedoch unverändert. Er ist für die Auflösung der Sialinsäure von wesentlicher Bedeutung (essentiell) und wird von Neuraminidasehemmern wie Zanamivir bzw. Oseltamivir verstopft.
Oseltamivir vermindert also den Austritt der Tochtervirionen aus den bereits infizierten Zellen und damit die Wahrscheinlichkeit, dass sich das Influenzavirus im Körper weiter ausbreitet. Das Präparat kann so dazu beitragen, dass die Krankheitsdauer geringfügig (im Mittel bei Erwachsenen um einen Tag) verkürzt wird, die Symptome der Grippe gemildert und eventuell gefährliche Folgekomplikationen, wie z. B. Lungenentzündungen, verhindert werden. Ein wissenschaftlicher Beweis für eine Verringerung der Mortalität durch die Einnahme von Tamiflu liegt indes bislang nicht vor.[24]
Einsatz in der Therapie
Um die Symptome einer Virusgrippe zu mindern, wird vom Hersteller vorgegeben, das Medikament so früh wie möglich nach Beginn der Krankheitserscheinungen einzunehmen. Optimal sei ein Behandlungsbeginn innerhalb von 36 Stunden nach dem Auftreten erster Grippesymptome, spätestens sollte der Einsatz nach zwei Tagen erfolgen. Je eher die Therapie beginnt, desto wahrscheinlicher ist ein möglicher Behandlungserfolg.
Häufigere unerwünschte Wirkungen
Häufige Nebenwirkungen sind Übelkeit, Erbrechen und Magenschmerzen. Ferner können allergische Reaktionen auftreten sowie eine Verschlechterung bereits bestehender Erkrankungen der Atemwege. Um mögliche Nebenwirkungen auf den Magen-Darm-Trakt zu vermeiden, sollte Tamiflu möglichst zusammen mit etwas Nahrung eingenommen werden. Es gibt zurzeit keine gesicherten Erfahrungen mit dem Wirkstoff bei der Behandlung von Patienten mit schweren chronischen Erkrankungen (zum Beispiel bei Asthma, Immunschwäche nach Operationen) oder anderen gravierenden Krankheitszuständen.
Mögliche neuropsychiatrische Vorfälle bei Jugendlichen
Im November 2005 wurden Berichte aus Japan bekannt, denen zufolge Entzündungen im Gehirn und erhebliche neuropsychiatrische Nebenwirkungen bei Kindern und Jugendlichen beobachtet wurden, die infolge einer Influenza-Infektion Tamiflu (Wirkstoff: Oseltamivir) eingenommen hatten. In Japan wird daher seit einiger Zeit auch auf Bewusstseinstrübungen, Halluzinationen und Krämpfe als mögliche Nebenwirkungen hingewiesen.
Die US-Arzneimittelbehörde FDA kam nach einer Überprüfung zunächst zu dem Ergebnis, dass die Symptome vermutlich auf die Grunderkrankung und nicht auf das Medikament zurückzuführen seien. Eine Steigerung der gemeldeten Fallzahlen neuropsychiatrischer Erkrankungen sei schon aus den 1990er Jahren bekannt, also bevor Tamiflu eingesetzt wurde. Ursache für diese Steigerung sei unter anderem eine erhöhte Bereitschaft der japanischen Ärzte solche Symptome zu melden. Nach Prüfung von mehr als 100 Fällen von abnormem Verhalten sprachen sich die mit der Prüfung beauftragten Experten der FDA Mitte November 2006 aber ebenfalls dafür aus, auf der Verpackung die Überwachung von Tamiflu-Patienten zu empfehlen, auch wenn noch immer offen sei, ob die neuropsychiatrischen Phänomene auf die Einnahme des Medikaments zurückzuführen seien oder ob es sich um Ereignisse gehandelt habe, die nur zufällig nach Einnahme von Tamiflu auftraten.
Das Committee for Medicinal Products for Human Use (CHMP) der Europäischen Arzneimittelagentur beobachtet zwar ebenfalls die Berichte über mögliche neuropsychiatrische Nebenwirkungen,[25] bekräftigte aber am 17. November 2006, dass die Aussage der Behörde vom gleichen Tag des Vorjahres weiterhin gelte. Am 17. November 2005 hatte die Behörde mitgeteilt, ein ursächlicher Zusammenhang zwischen Tamiflu und den aus Japan beschriebenen Halluzinationen und abnormen Verhaltensweisen sei nicht nachweisbar gewesen.[26]
Am 21. März 2007 verschärfte das japanische Gesundheitsministerium erneut die Warnhinweise. Es wurde vorbeugend angeordnet, dass die Produktinformationen vor einer Verschreibung für Jugendliche warnen müssen.[27] Zugleich wurde jedoch durch das japanische Ministerium erneut festgestellt, dass ein ursächlicher Zusammenhang zwischen Tamiflu und psychischen Störungen (Depressionen) nicht erkennbar sei. In deutschen Presseberichten wurde Ulrich Hagemann, Abteilungsleiter im Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM), mit der Aussage zitiert, dass es aus der EU keine Berichte über vergleichbare Auffälligkeiten von Jugendlichen nach Einnahme von Oseltamivir gebe.[28] Gleichwohl empfahl das CHMP am 23. März 2007: „Patienten, insbesondere Kinder und Heranwachsende, sollten genau überwacht und ihre medizinischen Betreuer umgehend informiert werden, falls die Patienten Anzeichen von ungewöhnlichem Verhalten zeigen.“[29]
Wechselwirkungen mit anderen Medikamenten
Oseltamivir kann zusammen mit Paracetamol, Ibuprofen oder Acetylsalicylsäure (Aspirin) eingenommen werden, wobei als Wechselwirkung eine Verringerung der Wirksamkeit der Medikamente beschrieben wird.
Resistenzen
Für einiges Aufsehen sorgten die in der Online-Ausgabe der angesehenen Fachzeitschrift Nature dargestellten Fakten zu einem gesicherten Resistenzfall, der auch in der Presse immer wieder (aber meist ohne konkrete Einzelheiten) erwähnt wird.[30] Der Veröffentlichung zufolge wurde in Vietnam ein 21-jähriger Patient erst acht Tage nach dem Auftreten der ersten Krankheitsanzeichen (39,5 °C Fieber und Husten) und einen Tag nach Feststellung einer schweren Lungenentzündung (severe pneumonia syndrome) anschließend für einen Zeitraum von sieben Tagen mit der zur Behandlung von Erwachsenen empfohlenen Tagesdosis von zweimal täglich 75 mg so erfolgreich behandelt, dass er anschließend das Krankenhaus verlassen konnte. Seine 14-jährige Schwester infizierte sich ebenfalls (eventuell bei ihrem Bruder) und wurde ab dem zweiten Tag nach Auftreten von mildem Fieber und leichtem Husten mit der für Erwachsene vorgesehenen prophylaktischen Dosis von einmal pro Tag 75 mg insgesamt vier Tage lang behandelt. Unter dieser Therapie verstärkten sich bei ihr die Krankheitssymptome, und die Patientin bekam daher an den folgenden sieben Tagen die therapeutische Erwachsenendosis (2×75 mg). Unter dieser Wirkstoffdosierung klangen die Symptome schließlich ab, obwohl in Untersuchungsproben vom vierten Behandlungstag (von insgesamt 11) bei dem bei ihr gefundenen Erregervirus und den von diesem angefertigten viralen Klonen von Forschern eine deutliche Resistenz dieses Virusstammes (294S) gegen Oseltamivir festgestellt wurde. Auch diese Patientin konnte das Krankenhaus anschließend wieder verlassen.
Die Autoren der Studie weisen selbst darauf hin, dass anhand dieses Einzelfalles kaum Aussagen darüber möglich sind, wie rasch eine zu niedrige Dosierung nach bereits eingetretener Infektion auch bei anderen Personen zu einer Resistenzbildung führen könnte, empfehlen aber eine genaue Beobachtung der Situation bei den Erkrankten.
Die gleiche, zu verringerter Empfindlichkeit gegen Oseltamivir führende Genveränderung wurde Anfang Januar 2007 bei zwei verwandten Personen nachgewiesen, die am 25. bzw. 28. Dezember 2006 in Ägypten an den Folgen einer H5N1-Infektion verstorben waren. Beide waren seit dem 21. Dezember vergeblich mit Oseltamivir behandelt worden. Die WHO erklärte am 18. Januar 2007, dass es keine Anhaltspunkte gebe, die Oseltamivir-Resistenz sei in Ägypten oder anderswo weit verbreitet.[31]
In der Grippesaison 2007/2008 sind in vier europäischen Ländern gegen Oseltamivir resistente Virenstämme nachgewiesen worden. Insgesamt 13 % (19 von 148) der untersuchten Proben wiesen in vitro eine Mutation auf, die eine Resistenz erzeugt.[32] Ende Januar 2008 wurde von norwegischen Ärzten auch bei normalen Grippepatienten ein gegen Oseltamivir resistenter Virusstamm (A/H1N1-H274Y) entdeckt,[33] der danach auch weltweit verbreitet gefunden wurde.[34] Für die Grippesaison 2007/2008 in den USA wurde auf Basis von Resistenztestungen ermittelt, dass bei 12,3 % der H1N1-Infizierten eine Resistenz gegen den Wirkstoff vorlag. Aus den vorläufigen Daten zur Grippesaison 2008/2009 zogen die Forscher den Schluss, dass rund 98 % der von ihnen untersuchten H1N1-Virusproben gegen Oseltamivir resistent waren.[35] Daten der WHO von März 2009 bestätigen bei 1291 von 1362 Proben aus 30 Ländern die hohe Resistenzbildung zur Grippesaison 2008/2009.[36]
Nach Angaben der Firmenzentrale von Hoffmann-La Roche in Basel und dem Statens Serum Institut (SSI) in Dänemark ist dort Ende Juni 2009 bei einem Patienten unter der Behandlung mit Oseltamivir zum ersten Mal eine Oseltamivir-Resistenz bei der sogenannten Schweinegrippe (offizielle WHO-Bezeichnung: pandemisches H1N1/09-Virus) aufgetreten, weshalb der betreffende Patient nach dem Absetzen von Oseltamivir anschließend mit dem Wirkstoff Zanamivir behandelt worden ist. Vereinzelte Resistenzen wurden kurz danach auch aus Hongkong und Japan bekannt.[37]
Metabolite von Oseltamivir werden in Kläranlagen nicht abgebaut.[38] So wurden bei einer Grippewelle in Japan so hohe Konzentrationen von Oseltamivir-Abbauprodukten in Gewässern nachgewiesen, dass die Entwicklung von Oseltamivir-resistenten Virenstämmen im Magen-Darm-Trakt von Wasservögeln als möglich bezeichnet wird. Da auch Grippeviren oft bei Vögeln mutieren, besteht die Möglichkeit der Entstehung eines von Beginn an Oseltamivir-resistenten Grippevirus, gegen den dann noch kein passender Impfstoff vorhanden wäre.
Einsatz in der Prophylaxe
Das Medikament kann eingeschränkt zur Vorbeugung eingesetzt werden, wenn im Umfeld bereits ein oder mehrere Influenzafälle eindeutig festgestellt wurden und ein Kontakt mit dem oder den Infizierten nicht ausgeschlossen werden kann. In der Fachinformation von Tamiflu (Stand: Mai 2009) wird allerdings darauf hingewiesen, dass dieses Medikament kein Ersatz für eine Grippeschutzimpfung gegen die bekannten, seit Jahren umlaufenden Humangrippeviren ist. Eine Verwendung zur Vorbeugung sei lediglich angezeigt, wenn eine Impfung vorher aus medizinischen Gründen bei einem Patienten nicht durchzuführen war oder zu einem Zeitpunkt nicht möglich bzw. nicht mehr effektiv sei, wie zum Beispiel bei einer rasch auftretenden Pandemie.
Als Reaktion auf die aus Japan berichteten, möglichen neuropsychiatrischen Vorfälle bei Jugendlichen empfahl das arznei-telegramm 4/2007: „Angesichts des marginalen Nutzens bei gesunden Kindern und Erwachsenen und des fehlenden Nachweises einer Wirksamkeit bei Patienten mit chronischen kardialen und/oder respiratorischen Erkrankungen raten wir von Oseltamivir bei Virusgrippe ab.“[39]
Eine Studie zur Therapietreue (Compliance) und zu unerwünschten Wirkungen der prophylaktischen Oseltamivir-Anwendung unter 248 englischen Schulkindern wurde im Juli 2009 veröffentlicht.[40] Angesichts der Häufigkeit und Schwere der Nebenwirkungen, so klagten 31 % über ein Gefühl sehr krank zu sein, 24 % über Kopfschmerzen und 21 % über Magenschmerzen, wird empfohlen, die prophylaktische Anwendung unter sorgfältiger Abwägung der erwünschten und unerwünschten Wirkungen zu betrachten.
Zur Abschätzung der Folgen einer Einnahme des Medikaments über längere Zeitspannen (Wochen, Monate) gibt es jedoch zurzeit noch keine Studien. Sollte das Medikament zur Langfrist-Prophylaxe eingesetzt werden, ist daher ein Auftreten zusätzlicher, gravierender Nebenwirkungen nicht auszuschließen. Ob der Wirkstoff die Todesrate bei einer Grippe-Epidemie senken wird, ist letztlich ungeklärt. Wie sinnvoll ein Einsatz des Wirkstoffs zur langfristigen Vorbeugung im Falle einer Epidemie tatsächlich sein könnte, lässt sich bislang also nicht eindeutig bestimmen.[41]
Die Anwendung dieses Medikaments und auch anderer in Frage kommender Arzneimittel (wie beispielsweise die Dosierung) bei Behandlung und Prophylaxe der Grippe sollte unbedingt auf der Basis aktueller offizieller Empfehlungen und denen des behandelnden Arztes erfolgen. Mit neuen wissenschaftlichen Erkenntnissen hinsichtlich einerseits der Wirksamkeit und der Nebenwirkungen der Wirkstoffe bei Vorbeugung und Therapie auch und besonders in Abhängigkeit von der Anwendungsdauer und andererseits einer möglichen erregerseitigen Ausbildung von Resistenz gegenüber diesen Arzneimitteln ist jederzeit zu rechnen. Als aktuelle Informationsquelle kann hierzu auch das Robert Koch-Institut dienen.
Maßnahmen zur Vorbeugung gegen eine H5N1-Pandemie
Die Weltgesundheitsorganisation (WHO) hat zur Verhinderung einer von ihr befürchteten Influenza-Pandemie durch das Vogelgrippe-Virus H5N1 allen Staaten geraten, so große Mengen dieses Mittels vorrätig zu halten, dass mit ihnen 25 % der Bevölkerung versorgt werden könnten. Das Grippemittel ist möglicherweise geeignet, die Zeit bis zur Entwicklung eines Impfstoffs zu überbrücken. In Laborkulturen und auch in Testtieren wurde eine antivirale Aktivität gegen diesen Subtyp des Influenza-A-Virus nachgewiesen. Auf Grund der geringen Anzahl an erkrankten Personen fehlen jedoch weitgehend klinische Untersuchungen zur Wirksamkeit von Oseltamivir bei der Vogelgrippe H5N1.[2]
Nach Frankreich, Norwegen, Großbritannien, der Schweiz und den USA hat auch Deutschland im August 2005 sechs Millionen Dosen des Grippemittels bestellt. Kritiker weisen jedoch darauf hin, dass diese Zahl im Ernstfall viel zu gering wäre: Statt für 25 % (WHO-Empfehlung) oder 20 % (Robert Koch-Institut) der Bevölkerung werden in einigen Bundesländern lediglich für 10 % (Hamburg) bzw. 4,5 % (Sachsen-Anhalt) der Bevölkerung Medikamentendosen vorrätig gehalten.[42] Allein vom Freistaat Bayern wurden 2006 rund 21,9 Mio. € für die Beschaffung von Medikamenten gegen eine mögliche Influenza-Pandemie ausgegeben.[43] Einem Unternehmenssprecher zufolge verhandle der Hersteller mit der deutschen Regierung über die Lieferung weiterer Dosen. In Baden-Württemberg, Berlin, Hessen, Rheinland-Pfalz oder Nordrhein-Westfalen lagert der Wirkstoff auch in Säcken und soll im Bedarfsfall kurzfristig abgefüllt werden. Die Bundesregierung sieht in Tamiflu weiterhin ein „geeignetes Mittel“ und bunkert 7,5 Millionen Therapieeinheiten als „Bundesreserve“.[44] Die französische Zeitung Libération berichtete Ende August, die französische Regierung habe bereits fünf Millionen Dosen des Grippemittels gekauft und beabsichtige, diese Zahl bis Jahresende auf 14 Millionen Dosen zu erhöhen. Tamiflu ist 7 Jahre haltbar.[45] Über elf Milliarden Euro nahm Roche bis Ende 2016 durch die Verkäufe ein, geschätzt etwa die Hälfte davon geht auf prophylaktische Einlagerungen für den Pandemiefall zurück. Selbst Unternehmen bauten Notvorräte für Mitarbeiter auf.[44]
Da die Produktion dieses Medikaments sehr viel Zeit erfordert und sehr aufwendig ist, reservieren Staaten und Bundesländer (Niederösterreich, Steiermark, Brandenburg) bereits jetzt[Datum?] dieses Produkt, um im Falle einer Epidemie genügend Vorräte zu haben.
In den Medien
Auch zahlreiche Medienberichte haben wohl dazu beigetragen, dass das Interesse an Oseltamivir und Zanamivir erheblich gestiegen ist. So wurden im Spätsommer 2005 mehr als 130.000 Packungen dieser Arzneimittel verkauft. 2004 waren es im gleichen Zeitraum lediglich 30.000 Packungen. Dies hat, kombiniert mit dem Problem der zeitaufwändigen Wirkstoffherstellung, dazu geführt, dass die Firma Roche die Lieferungen nach Deutschland beschränkt hat.
Einige Medien berichteten, dass die Firma Roche diesen Umsatzzuwachs mehr oder weniger indirekt gefördert habe. So hieß es in einem Beitrag des ARD-Magazins Monitor vom 11. August 2005, Berichte über die Wirksamkeit des Medikaments seien von PR-Abteilungen gezielt an die Medien ausgegeben worden. Dies geschah allerdings nicht als offizielle Werbung, sondern unter dem Mantel eines seriösen journalistischen Beitrags, was viele Redaktionsmitarbeiter wohl nicht erkannt hatten. Aufgrund einiger Rechtsstreitigkeiten wurde der Bericht inzwischen vorsorglich von der Webseite des Magazins entfernt. Als Quelle für diese journalistischen Beiträge wurde meistens das Institut für Gesundheitsaufklärung (kurz: IFGA) genannt. Viele Redaktionen haben offensichtlich diese Angaben nicht weiter hinterfragt, obwohl eine derartige „Öffentlichkeitsarbeit“ von Pharmakonzernen hinlänglich bekannt ist.
Das Nachrichtenmagazin Der Spiegel berichtete am 19. November 2005 indes von einer zunehmenden Besorgtheit des Konzerns um den eigenen Ruf. So habe anhaltende negative Berichterstattung das Image der Firma insbesondere in den USA beschädigt. Tatsächlich wurde in den Medien zuvor vielfach kritisiert, dass sich der Pharmakonzern trotz der sich anbahnenden Gefahr einer Influenza-Epidemie nicht oder nur halbherzig von den Exklusivrechten für das Medikament trenne. Zur Verbesserung des Ansehens plane Roche laut des vorliegenden Berichts, die Zusammenarbeit mit der PR-Firma Fleishman-Hillard zu vertiefen, um so „proaktiv“ Einfluss auf die Medien zu nehmen.
In jüngerer Zeit wird in den Medien auch vor der massenweisen Anwendung gewarnt, weil die damit verbundene Ausscheidung die Gewässersysteme derart belaste, dass möglicherweise mit einer erheblichen Umweltbelastung der natürlichen Mikroflora und erheblichen Resistenzbildungen bei den Virenstämmen zu rechnen ist.[46]
Kritik
Über mehrere Jahre hinweg bemühte sich das British Medical Journal eigenen Angaben zufolge darum, Einblick in die Rohdaten nehmen zu dürfen, die den optimistischen Angaben zur Wirkungsweise von Oseltamivir zugrunde lagen.[47] Bemängelt wurde unter anderem, dass die bei den Behörden eingereichten Namen der entwickelnden Wissenschaftler nicht mit den Autoren übereinstimmten, die die Veröffentlichungen verfasst hatten, was die Frage nach einem Ghostwriter und dessen Kompetenz aufwarf.[48] Daneben war unter den von Roche zitierten Studien zur Wirksamkeit keine unabhängig finanzierte Studie.[48] Nachdem diese Forderung nicht erfüllt wurde, stellte das British Medical Journal den gesamten Schriftverkehr in dieser Sache schließlich im Januar 2013 im Rahmen seiner „Open Data Campaign“ online.[49] Der Tages-Anzeiger kommentierte den Schriftverkehr als „entlarvend“: Aus der „detaillierten Dokumentation“ gehe hervor, die „Gesundheitsbehörden rund um den Globus“ hätten sich „mit unvollständigen Unterlagen des Pharmakonzerns begnügt“, als sie „für Milliarden Steuergelder Tamiflu“ auf Vorrat einkauften.[50] Als die Daten dann schließlich zugänglich waren, titelte die Süddeutsche „Sargnagel für Tamiflu.“[51] Zwei von der europäischen Zulassungsbehörde hinzugezogene Experten des belgischen Gesundheitsministeriums und des schwedischen Instituts für Infektionskrankheiten haben Verbindungen zu Roche. An der Ausarbeitung der WHO-Pandemieleitlinien waren auch Experten beteiligt, die zuvor an einer von Roche finanzierten Studie mitarbeiteten – diese Untersuchung gilt als wichtigstes Werk für den Nutzenbeleg von Tamiflu. Eine Auswertung von zehn Studien wurde maßgeblich von Roche-Mitarbeitern oder bezahlten Beratern verfasst. Sogar Mitarbeiter einer Agentur für medizinische Kommunikation sollen an einem Manuskript für eine Studie zu Oseltamivir als Ghostwriter mitgewirkt haben. Statistiker unterstellten zudem manchen Studien beträchtliche methodische Mängel.[44] "British Medical Journal" (BMJ) Chefredakteur Peter Doshi schrieb: "... kam ans Licht, dass Regierungen auf der ganzen Welt Milliarden ausgegeben hatten, um antivirale Influenza-Medikamente zu horten, von denen nicht gezeigt wurde, dass sie das Risiko von Komplikationen, Krankenhauseinweisungen oder Tod verringert."[52]
Weblinks
- Reto U. Schneider: Das Rennen um GS4104. NZZ Folio, 01/2004 – Bericht über die Entwicklung von Tamiflu.
- Summary of Evidence for Benefits and Harms of the Use of Influenza Antiviral Agents against Pandemic Influenza A H1N1 (2009) Infections. (PDF; 170 kB) WHO, November 2010.
- Robert Koch-Institut: offizielle Empfehlungen zum Management bei Vogelgrippe
- Nike Heinen: Die Tamiflu-Lüge. Weniger Wirkung, mehr Nebenwirkungen: Publizierte Daten zu Grippe-Medikamenten sind massiv geschönt. Sueddeutsche.de (SZ-Printausgabe, 17. Dezember 2010)
- Tamiflu hat schwerere Nebenwirkungen als gedacht. Welt Online, 18. Januar 2012 (Bericht über Nebenwirkungen)
- Öffentlicher Beurteilungsbericht (EPAR) der europäischen Arzneimittelagentur (EMA) zu: Oseltamivir
Einzelnachweise
- Datenblatt Oseltamivir phosphate, ≥98% (HPLC) bei Sigma-Aldrich, abgerufen am 31. Oktober 2016 (PDF).
- H. J. Schünemann, S. R. Hill, M. Kakad et al.: WHO Rapid Advice Guidelines for pharmacological management of sporadic human infection with avian influenza A (H5N1) virus. In: Lancet Infect Dis. 7, Nr. 1, Januar 2007, S. 21–31. doi:10.1016/S1473-3099(06)70684-3. PMID 17182341.
- Tom Jefferson, Mark A Jones, Peter Doshi et al.: Neuraminidase inhibitors for preventing and treating influenza in healthy adults and children. In: British Medical Journal. 2014, Online-Vorabveröffentlichung vom 10. April 2014, doi:10.1002/14651858.CD008965.pub4.
- Zosia Kmietowicz: WHO downgrades oseltamivir on drugs list after reviewing evidence. BMJ, online 12. Juni 2017; abgerufen am 1. Juli 2019
- arznei-telegramm (PDF; 28 kB).
- Rekordergebnis: Höchster Gewinn der Firmengeschichte für Roche. In: tagesspiegel.de. Abgerufen am 13. November 2018.
- n-tv Nachrichten: Roche hält an Ausblick fest. In: n-tv.de. 17. April 2008, abgerufen am 13. November 2018.
- Roche: Halbjahresbericht 2011. (PDF; 2,0 MB)
- Roche: Halbjahresbericht 2018. (PDF; 2,5 MB)
- eurekalert.org vom 17. Januar 2012: Continuing uncertainties surround anti-influenza drug.
- eurekalert.org vom 17. Januar 2012: Effects of Tamiflu still uncertain, warn experts, as Roche continues to withhold key trial data.
- nature.com vom 13. Januar 2012: Researchers renew fight with Roche over flu drug evidence.
- welt.de vom 18. Januar 2012: Tamiflu hat schwerere Nebenwirkungen als gedacht.
- T. Jefferson, V. Demicheli, D. Rivetti, M. Jones, C. Di Pietrantonj, A. Rivetti: Antivirals for influenza in healthy adults: systematic review. In: Lancet. Band 367, Nummer 9507, Januar 2006, S. 303–313, doi:10.1016/S0140-6736(06)67970-1, PMID 16443037 (Review).
- Toshihiro Tanaka et al.: Safety of neuraminidase inhibitors against novel influenza A (H1N1) in pregnant and breastfeeding women. In: Canadian Medical Association Journal. 2009, Band 181, Nr. 1–2, S. 55–58, doi:10.1503/cmaj.090866.
- FDA: Tamiflu auch bei Kindern unter 1 Jahr sicher. Ärzteblatt.de
- Factsheet Tamiflu. (Memento vom 22. Februar 2016 im Internet Archive; PDF; 336 kB) Hoffmann-La Roche, Stand 17. November 2006.
- Japanese researcher finds synthetic route to Tamiflu. Nature, 8. März 2006.
- T Mita, N Fukuda, FX Roca, M Kanai, M Shibasaki: Second generation catalytic asymmetric synthesis of Tamiflu: allylic substitution route. In: Org. Lett.. 9, Nr. 2, Januar 2007, S. 259–262. doi:10.1021/ol062663c. PMID 17217279.
- Satoh N, Akiba T, Yokoshima S, Fukuyama T: A practical synthesis of (–)-oseltamivir. (PDF) In: Angew. Chem. Int. Ed. Engl.. 46, Nr. 30, 2007, S. 5734–5736. doi:10.1002/anie.200701754. PMID 17594704.
- BM Trost, T Zhang: A concise synthesis of (–)-oseltamivir. In: Angew. Chem. Int. Ed. Engl.. 47, Nr. 20, 2008, S. 3759–3761. doi:10.1002/anie.200800282. PMID 18399551.
- Ying-Yeung Yeung, Sungwoo Hong, E. J. Corey: A Short Enantioselective Pathway for the Synthesis of the Anti-Influenza Neuramidase Inhibitor Oseltamivir from 1,3-Butadiene and Acrylic Acid. In: J. Am. Chem. Soc., 2006, 128(19), S. 6310–6311; (Communication) doi:10.1021/ja0616433.
- Research groups in the U.S. and Japan develop routes that avoid shikimic acid. In: Chemical & Engineering News, 2006, Band 84, Nr. 18, S. 5.
- Welchen Nutzen haben Neuraminidase-Hemmer bei einer Grippe-Pandemie? In: arznei-telegramm. A.T.I., Berlin 36, 2005, Nr. 7, S. 62f. ISSN 0066-8192.
- Pressemitteilung. (Memento vom 8. Oktober 2009 im Internet Archive; PDF; 105 kB)
- European Medicines Agency update on the safety of Tamiflu (emea) (Memento vom 8. Oktober 2009 im Internet Archive) vom November 2005 (pdf; 100 kB).
- handelsblatt.com und diverse Agenturmeldungen vom 22. März 2007.
- Meldung der Agentur afp vom 22. März 2007, 16:44 Uhr.
- ema.europa.eu (Memento vom 8. Oktober 2009 im Internet Archive) (PDF; 30 kB) Pressemitteilung vom 23. März 2007.
- Le Qm et al.: Avian flu, isolation of drug-resistant H5N1 virus. In: Nature, London 2005, Band 437, Nr. 7062, 20. Oktober, S. 1108, PMID 16228009.
- Epidemic and Pandemic Alert and Response der WHO: „At this time there is no indication that oseltamivir resistance is widespread in Egypt or elsewhere.“ vom 18. Januar 2007.
- Robert Koch-Institut: Influenza: Zum Auftreten von Resistenzen gegen Oseltamivir bei Influenzaviren des Suptyps A/H1N1. von 1. Februar 2008.
- Resistance to oseltamivir (Tamiflu) in some influenza A(H1N1) virus samples. ECDC, 20. September 2008.
- Influenza A(H1N1) virus resistance to oseltamivir – 2008 influenza season, southern hemisphere. (Memento vom 2. April 2015 im Internet Archive) (PDF; 33 kB) WHO, 20. August 2008.
- N. J. Dharan, L. V. Gubareva, J. J. Meyer et al.: Infections With Oseltamivir-Resistant Influenza A(H1N1) Virus in the United States. In: JAMA. 2. März 2009, Band 301, Nr. 10, doi:10.1001/jama.2009.294.
- Influenza A(H1N1) virus resistance to oseltamivir – 2008/2009 influenza season,northern hemisphere. (PDF; 39 kB) WHO, 18. März 2009.
- Transcript of virtual press conference with Dr. Keiji Fukuda, Assistant Director-General ad Interim for Health Security and Environment, World Health Organization. (PDF; 70 kB) who.int, 7. Juli 2009:
- „Lieber krank als tot“, Gefahr aus dem Tamifluss. In: taz, 24. Juli 2009.
- arznei-telegramm 2007; 38: 40 Abgerufen am 18. März 2020.
- A. Wallenstein et al.: Compliance and side effects of prophylactic oseltamivir treatment in a school in South West England. In: Eurosurveillance. Band 14, Nr. 30, 2009, Volltext.
- Science, 5. August 2005, S. 871.
- Netzeitung (Memento vom 1. Mai 2012 im Internet Archive).
- Jahresbericht 2008, TNr. 8.1. (PDF; 738 kB) Bayerischer Oberster Rechnungshof, S. 20,
- Martin U. Müller: Grippemittel Tamiflu: Der Irrsinn um ein vermeintliches Wundermittel. In: Spiegel Online. 14. August 2017, abgerufen am 19. Februar 2018.
- European Medicines Agency recommendations on extension of shelf life for Tamiflu Erklärung der European Medicines Agency vom 8. Mai 2009.
- Andrew Singer, Oxford University, nach Der Spiegel 2007, 5, 130.
- Tamiflu: the battle for secret drug data In: British Medical Journal. 2012, Band 345, e7303, doi:10.1136/bmj.e7303.
- F. Godlee, M. Clarke: Why don’t we have all the evidence on oseltamivir?. In: BMJ. Band 339, 2009, S. b5351–b5351, doi:10.1136/bmj.b5351.
- Tamiflu correspondence with Roche
Tamiflu correspondence with the World Health Organization
Tamiflu correspondence with the Centers for Disease Control and Prevention
Correspondence with the European Medicines Agency. - Zweifel an Tamiflu – Der Druck auf Roche nimmt zu. In: Tages-Anzeiger, 26. Januar 2013 (Online gesichtet am 28. Januar 2013).
- Sargnagel für Tamiflu. In: Süddeutsche, 10. April 2014 (Online 3. April 2016).
- Covid-19 vaccines and treatments: we must have raw data, now. In: BMJ. Editorial by Peter Doshi (seniour editor), 19. Januar 2022.