Loxapin
Loxapin (Handelsname Adasuve) ist eine synthetisch hergestellte chemische Verbindung aus der Gruppe der Dibenzoxazepin-Derivate, die als Arzneistoff (Neuroleptikum) zur schnellen Kontrolle von leichter bis krankhafter Unruhe bei erwachsenen Patienten mit Schizophrenie oder bipolarer Störung eingesetzt wird.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
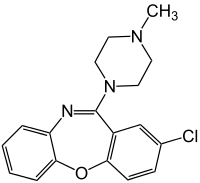 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Loxapin | |||||||||||||||||||||
| Andere Namen |
2-Chlor-11-(4-methylpiperazin-1-yl)dibenzo[b,f][1,4]oxazepin (IUPAC) | |||||||||||||||||||||
| Summenformel | C18H18ClN3O | |||||||||||||||||||||
| Kurzbeschreibung |
farbloser Feststoff[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code |
N05AH01 | |||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Wirkmechanismus |
Antagonist an D2–Rezeptor-5HT2A-Rezeptor (Hauptwirkmechanismus) | |||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 327,81 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Schmelzpunkt |
151–153 °C (Succinat)[1] | |||||||||||||||||||||
| Löslichkeit |
löslich in Dimethylsulfoxid (DMSO)[2] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Klinische Angaben
Anwendungsgebiete (Indikationen)
Loxapin ist angezeigt zur schnellen Kontrolle von leichter bis mittelschwerer Agitiertheit bei erwachsenen Patienten mit Schizophrenie oder bipolare Störung.[4]
Art und Dauer der Anwendung
Loxapin ist das erste inhalativ anzuwendende Neuroleptikum. Es darf derzeit nur unter stationären Bedingungen angewendet werden.[4] Es ist in Dosen von 4,5 mg bis zu maximal zwei mal je 9,1 mg wirksam. Unmittelbar nach der Behandlung der akuten Agitationssymptomen ist eine reguläre Behandlung einzuleiten.[5]
Gegenanzeigen (Kontraindikationen)
Gegenanzeigen sind eine Überempfindlichkeit gegen den Loxapin oder den Metaboliten Amoxapin sowie Patienten mit akuten respiratorischen Symptomen oder aktiven Atemwegserkrankungen (Asthma oder chronisch-obstruktiver Lungenerkrankung COPD).[5]
Wechselwirkungen mit anderen Medikamenten
Die gleichzeitige Anwendung von Loxapin mit Alkohol, Beruhigungs- und Schlafmitteln wie beispielsweise den Benzodiazepinen oder Wirkstoffen, die die Atemfunktion behindern (beispielsweise opioide Schmerzmittel), kann mit übermäßiger Schläfrigkeit und Atemfunktionsstörungen bis zum Atemversagen verbunden sein. Loxapin wird von dem Enzymsystem CYP1A2 abgebaut. Der schnellere Abbau bewirkt, dass die Blutkonzentration an Loxapin und seinen Stoffwechselprodukten bei Rauchern niedriger ist als bei Nichtrauchern. Die gleichzeitige Anwendung von Wirkstoffen wie dem Psychopharmakon Fluvoxamin, den Antibiotika Ciprofloxacin und Enoxacin, dem Blutdrucksenker Propranolol oder dem Entzündungshemmer Rofecoxib kann die Nebenwirkungen von Loxapin verstärken.[5]
Schwangerschaft und Stillzeit
Neugeborene, die während des dritten Trimenons der Schwangerschaft wiederholt gegenüber Antipsychotika exponiert waren, sind durch Nebenwirkungen einschließlich extrapyramidaler Symptome und/oder Entzugserscheinungen gefährdet, deren Schwere und Dauer nach der Entbindung variieren können. Im Tierversuch wurde gezeigt, dass Loxapin und seine Metaboliten bei laktierenden Hündinnen in die Milch übergehen. Die Menge, in der Loxapin oder seine Metaboliten in die Muttermilch abgesondert werden, ist nicht bekannt.[5]
Besondere Patientengruppen
Die Sicherheit und Wirksamkeit von Loxapin bei Patienten unter 18 Jahren oder über 65 Jahren sowie bei Leber- oder Nierenfunktionsstörungen ist nicht belegt.[6]
Unerwünschte Wirkungen (Nebenwirkungen)
Sehr häufige Nebenwirkungen: Sedierung/Somnolenz, Geschmacksstörung. Häufige Nebenwirkungen: Schwindel, Rachenreizung, Mundtrockenheit, Müdigkeit. Gelegentliche Nebenwirkungen: Verstimmung, Dyskinesen, Dystonie, Okulogyration (kreisende Bewegung der Augen), Tremor, Akathisie/Unruhe, Hypotonie, Bronchialkrämpfe (einschließlich Keuchen, Atemnot oder Husten). Loxapin beeinflusst die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen.[5]
Pharmakologische Eigenschaften
Wirkungsmechanismus (Pharmakodynamik)
Loxapin ist ein Antagonist an dopaminergen D2-Rezeptoren und serotonergen 5-HT2A-Rezeptoren. Darüber hinaus bindet die Substanz an noradrenerge, histaminerge und cholinerge Rezeptoren, was für die pharmakologische Wirkung vermutlich auch eine Rolle spielt. Seine pharmakologische Einstufung als eher typisches Neuroleptikum, ist im Gegensatz zur chemischen Struktur (Dibenzoxazepin), die eine Einstufung als atypisches Neuroleptikum vermuten lässt – wahrscheinlich auf den äußerst stark ausgeprägten D2-Antagonismus (im Vergleich zum 5-HT2A -Antagonismus) und sein Nebenwirkungsprofil zurückzuführen. Dadurch kann gezielt die Wirkung von Dopamin und Serotonin unterdrückt werden. Arzneilich wird das Salz der Bernsteinsäure, das Loxapinsuccinat, verwendet.[4][7]
Aufnahme und Verteilung im Körper (Pharmakokinetik)
Die Pharmakokinetik des inhalativen Loxapins ähnelt der i.v. Gabe und aufgrund der raschen Resorption wirkt es entsprechend schnell. Die Zeit bis zum Erreichen der maximalen Plasmakonzentration (Tmax) beträgt zwei Minuten, die Wirkung tritt nach etwa zehn Minuten ein. Dies zeigt, dass Locaxapin eine extrem schnelle und innovative Alternative zu den bisherigen Therapieoptionen ist. Loxapin wird rasch aus dem Plasma entfernt und in die Gewebe verteilt. Tierexperimentelle Studien, die im Anschluss an eine orale Anwendung durchgeführt wurden, deuten auf eine anfänglich vorrangige Verteilung in Lunge, Gehirn, Milz, Herz und Nieren hin. Loxapin ist zu 96,6 % an humane Plasmaproteine gebunden. Es wird extensiv in der Leber unter Bildung mehrerer Metaboliten metabolisiert. Die drei wesentlichen Stoffwechselwege umfassen Hydroxylierung zur Bildung von 8-OH-Loxapin und 7-OH-Loxapin, N-Oxidation zur Bildung von Loxapin-N-oxid und Demethylierung zur Bildung von Amoxapin. 8-OH-Loxapin übt keine pharmakologische Wirkung auf den D2-Rezeptor aus, während der untergeordnete Metabolit, 7-OH-Loxapin, eine hohe Bindungsaffinität zu D2-Rezeptoren aufweist.Loxapin ist ein Substrat für mehrere CYP450-Isoenzyme. In-vitro-Studien zeigten, dass 7-OH-Loxapin primär durch CYP 3A4 und 2D6, 8-OH-Loxapin primär durch CYP 1A2, Amoxapin primär durch CYP 3A4,2C19 und 2C8 und Loxapin-N-oxid durch FMO gebildet werden. Die Ausscheidung von Loxapin erfolgt größtenteils innerhalb der ersten 24 Stunden. Die Metaboliten werden mit dem Urin in Form von Konjugaten und mit den Faeces unkonjugiert ausgeschieden. Die terminale Eliminationshalbwertzeit (T½) liegt zwischen 6 und 8 Stunden.[5]
Chemische und pharmazeutische Informationen
Synthese
Der erste Schritt der Synthese ist die Bildung eines Diarylethers mittels der Williamson-Ethersynthese, bei der ein Phenolat als Nukleophil den durch die ortho-ständige Nitrogruppe aktivierten Halogenaromaten im Sinne einer nukleophilen aromatischen Substitution (SNAr) angreift.[8] Alternativ ist auch eine Katalyse durch Kupfersalze möglich, was auch als Ullmann-Ethersynthese bezeichnet wird.[9] Dabei hat die Nitrogruppe die Funktion eines Aktivators für den ersten Reaktionsschritt.[10] Ein primäres aromatisches Amin wird im zweiten Schritt durch Reduktion der Nitrogruppe im sauren Milieu mithilfe von Metallen wie zum Beispiel Zink als Reduktionsmittel gebildet.[11]
Im Weiteren wird die primäre aromatische Aminogruppe mit Phosgen zum Isocyanat umgesetzt.[12] Da Phosgen sehr giftig ist, kann alternativ auch Chlorameisensäureethylester zum Einsatz kommen.[10] Danach erfolgt die Bildung eines N,N-disubstituierten Harnstoffderivats durch Addition des sekundären Amins von Methylpiperazin an die Isocyanat-Gruppe.[8][11]
Den letzten Schritt der Synthese bildet die hier etwas abgewandelte Bischler-Napieralski-Reaktion, die gewöhnlich zur Darstellung von Isochinolin eingesetzt wird.[12] Es kommt unter Einwirkung von Phosphoroxychlorid (POCl3) zu einer Cyclodehydratisierung. Mechanistisch handelt es sich um eine elektrophile aromatische Substitution (SEAr) am Aromaten, für die mehrere mögliche Mechanismen postuliert werden.
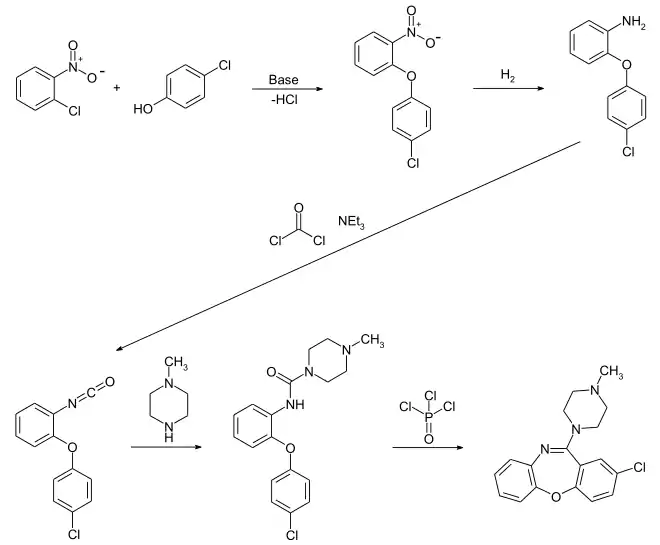
- Alternative Synthesewege
Da der Arzneistoff schon seit vielen Jahren bekannt ist und auch in anderen Ländern schon lange zum Einsatz kommt, finden sich noch weitere Möglichkeiten zur Synthese in der Literatur, unter anderem mit anderen Ausgangskomponenten oder alternativen Reaktionswegen. So kann beispielsweise der Einsatz von käuflich erwerbbarem 2-(4-Chlorphenoxy)anilin die ersten Schritte ersetzen[10] oder der Ringschluss über Bildung eines Lactams erfolgen.[11]
Identitätsprüfung
- Prüfung auf Chloridionen: Die dem Nachweis vorausgehende Halogenabspaltung aus der organischen Verbindungen erfolgt durch Hydrogenolyse mit nascierendem Wasserstoff (aus Zn/HCl oder Raney-Nickel/Ethanol). Die anschließende Fällung mit Silbernitrat (AgNO3) ergibt einen weißen Niederschlag.[13]
- Prüfung auf Amidine: Die säurekatalysierte Hydrolyse ergibt ein Amid und ein primäres aromatisches Amin. Nach Verseifung des Amids können die Reaktionsprodukte entsprechend nachgewiesen werden. Alternativ ist auch ein direkter Nachweis des Amids nach Aktivierung beispielsweise mittels Hydroxamsäure-Reaktion möglich.[13]
- Prüfung auf primäre aromatische Amine: Der Nachweis erfolgt über Diazotierung und Kupplung mit elektronenreichen Aromaten zu farbigen Azoverbindungen.[13]
- Prüfung auf tertiäre Amine: Wasserfreie Citronensäure gelöst in Acetanhydrid führt zum Aconitsäureanhydrid, welches mit tertiären Aminen eine purpurrote Färbung ergibt.[14]
- IR-Spektroskopie: v (C-H) 3050 cm−1 = Aromat; v (C-H) 3000-2850 cm−1 Alkan; 2200–1700 cm−1 Aromat Gerüstschwingung; v (C=C) 1600 cm−1 Aromat; v (CN) 1300–1200 cm−1 Piperazin; 710 cm−1 ortho-Aromat
 IR-Spektrum Loxapin
IR-Spektrum Loxapin
- Massenspektrometrie:Molekularpeak 327 m/z; Isotopenverhältnis von Chlor M+ = 327 m/z, M+2 = 329 m/z. Der Molekularpeak lässt auf eine ungerade Anzahl von Stickstoffatomen schließen, was bei Loxapin auch erfüllt ist. (N=3)
 Massenspektrum Loxapin
Massenspektrum Loxapin
Reinheitsprüfung
- Prüfung auf Schwermetalle: Da in der Synthese unter Umständen Schwermetalle wie z. B. Zink oder Kupfer verwendet werden, ist es sinnvoll im Rahmen der Reinheitsprüfung die Grenzbestimmung auf Schwermetalle mit Thioacetamid-Reagenz als Sulfitionendonor durchzuführen.
Gehaltsbestimmung
- Wasserfreie Titration: Da es sich bei Loxapin um einen schwach basischen Arzneistoff handelt, ist eine wasserfreie Titration mit Perchlorsäure in Eisessig (ein Äquivalenzpunkt durch das tertiäre Amin) möglich.[13]
- Fällungstitration: Nach Hydrogenolyse kann Chlorid mittels Fällungstitration (Silberchlorid) bestimmt werden. Indizierungsmöglichkeiten: Gay-Lussac, Mohr, Fajans.[13]
Siehe auch
Literatur
- M. S. Jain, S. J. Surana: Synthesis and evaluation of antipsychotic activity of 11-(40-(N-aryl carboxamido/N-aryl-a-phenylacetamido)-piperazinyl)-dibenz[b,f][1,4]-oxazepine derivatives. In: Arabian Journal of Chemistry. 2013, doi:10.1016/j.arabjc.2013.07.033.
- Wieland Gattermann: Die Praxis des organischen Chemikers. 43. Auflage. Walter de Gruyter, Berlin 1982, ISBN 3-11-006654-8.
- Helmut Krauch, Werner Kunz: Reaktionen der organischen Chemie. 6. Auflage. Hüthig, Heidelberg 1997, ISBN 3-7785-2112-8.
- Eberhard Ehlers: Analytik II – Kurzlehrbuch quantitative und instrumentelle pharmazeutische Analytik. 11. Auflage. Deutscher Apotheker Verlag, Stuttgart 2008, ISBN 978-3-7692-4160-0.
Einzelnachweise
- Datenblatt Loxapine succinate salt, solid bei Sigma-Aldrich, abgerufen am 28. August 2014 (PDF).
- ChemScene: Loxapine, abgerufen am 6. April 2015.
- flexyx.com: Loxapin (Memento vom 13. April 2013 im Internet Archive), abgerufen am 6. April 2015.
- Christian Asche, Gesa Tietjens: Neue Arzneistoffe 2013 - Loxapin. (Memento vom 28. Juli 2014 im Internet Archive) auf: apotheke-unterluess.de, abgerufen am 26. Juli 2014.
- ema.europa.eu: EPAR für Adasuve, abgerufen am 6. April 2015.
- Loxapin – zugelassen als inhalatives Antipsychotikum. Springer-Medizin, 31. Juli 2013, abgerufen am 8. September 2014.
- Clarissa Muhlack: Zertifizierte Fortbildung: Psychische Störungen. (Memento vom 10. August 2014 im Internet Archive) In: APOTHEKE + MARKETING 05/2014, S. 48.
- Eberhard Ehlers: Chemie II – Kurzlehrbuch Organische Chemie. 8. Auflage. Deutscher Apotheker Verlag, Stuttgart 2009, ISBN 978-3-7692-4884-5.
- T. Laue, A. Plagens: Namen- und Schlagwort-Reaktionen der Organischen Chemie. 5. Auflage. Vieweg + Teubner, GWV Fachverlage, Wiesbaden 2006, ISBN 3-8351-0091-2.
- R. S. Vardanyan, V. J. Hruby: Synthesis of Essential Drugs. Elsevier, 2006, ISBN 0-444-52166-6.
- Hans Peter Latscha, Uli Kazmaier, Helmut Alfons Klein: Organische Chemie – Chemie Basiswissen. 6. Auflage. Springer-Verlag, Berlin/Heidelberg 2008, ISBN 978-3-540-77106-7.
- J. Schmutz, F. Künzle, F. Hunziker, R. Gauch: Über in 11-Stellung amino-substituierte Dibenzo[b,f]-1,4-thiazepine und -oxazepine. In: Helvetica Chimica Acta. 1967, Vol. 50, S. 245–254. doi:10.1002/hlca.19670500131.
- Eberhard Ehlers: Analytik I – Kurzlehrbuch qualitative pharmazeutische Analytik. 9. Auflage. Deutscher Apotheker Verlag, Stuttgart 2007, ISBN 978-3-7692-4094-8.
- Hermann J. Roth, Kurt Eger, Reinhard Troschütz: Pharmazeutische Chemie II – Arzneistoffanalyse. 3. Auflage. Georg Thieme Verlag, Stuttgart 1990, ISBN 3-13-608403-9.