Isochinolin
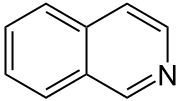
Isochinolin, auch 2-Azanaphthalin oder Benzo[c]pyridin genannt, ist eine organische Verbindung aus der Gruppe der Heteroaromaten und gehört zu den zweikernigen heterocyclischen Stammsystemen. Sie besteht aus zwei anellierten aromatischen sechsgliedrigen Ringen – einem Benzol- und einem Pyridinring –, woraus sich die Summenformel C9H7N ergibt. Formal handelt es sich somit um ein Naphthalinmolekül, bei welchem ein Kohlenstoffatom des Ringgerüsts durch ein Stickstoffatom ausgetauscht wurde. Es ist ein Strukturisomer des Chinolins.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Isochinolin | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C9H7N | |||||||||||||||||||||
| Kurzbeschreibung |
farblose ölige Flüssigkeit oder farblose Blättchen[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 129,16 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Dichte |
1,09 g·cm−3[2] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Siedepunkt |
243 °C[2] | |||||||||||||||||||||
| Dampfdruck | ||||||||||||||||||||||
| Löslichkeit |
schwer in Wasser (5 g·l−1 bei 20 °C)[4] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Unter dem Begriff Isochinoline wird eine große Klasse von chemischen Verbindungen zusammengefasst, die sich vom Isochinolin ableiten. Für eine Vielzahl natürlich vorkommender Alkaloide ist Isochinolin das Grundgerüst. Daher werden diese Alkaloide auch als Isochinolin-Alkaloide bezeichnet. Der Isochinolin-Grundkörper dieser Verbindungen leitet sich von der Aminosäure Tyrosin ab.
Vorkommen
1885 wurde Isochinolin erstmals von Hoogewerf und van Dorp aus Steinkohlenteer isoliert. Es konnte durch fraktionierte Kristallisation des Sulfats abgetrennt werden. Weissgerber entwickelte 1914 ein selektives Extraktionsverfahren zur schnellen und eleganten Abtrennung von Isochinolin. Das Verfahren nutzt dabei die Eigenschaft aus, dass Isochinolin stärker basisch als Chinolin ist. Natürlich kommt Isochinolin in Boldo vor.[5]
Gewinnung und Darstellung
Isochinolinderivate können mit einer Vielzahl von unterschiedlichen Reaktionen synthetisiert werden. Für die Synthese von Isochinolin selbst gibt es allerdings nur wenige direkte Synthesen.
Pomeranz-Fritsch-Reaktion
Die Pomeranz-Fritsch-Reaktion ist eine effektive Methode zur Synthese von Isochinolin. Sie geht von Benzaldehyd und Aminoacetaldehyddiethylacetal aus und findet im sauren Medium statt. Alternativ dazu können auch Benzylamin und Glyoxalacetal eingesetzt werden.
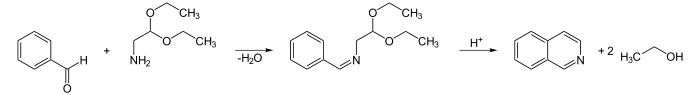
Synthesen von Isochinolinderivaten
Die nachfolgenden Synthesen können für verschiedene Isochinolinderivate genutzt werden:
- die Bischler-Napieralski-Reaktion
- die Pictet-Gams-Reaktion
- die Pictet-Spengler-Reaktion (Reaktion eines Phenylethylamins mit einem Aldehyd unter Wasserabspaltung zum Tetrahydroisochinolin und nachfolgend eine Oxidation zum Isochinolin)
Eigenschaften
Isochinolin ist eine bei Raumtemperatur farblose, hygroskopische Flüssigkeit, mit einem penetrant unangenehmen Geruch. Verunreinigtes Isochinolin sieht bräunlich aus. Beim Abkühlen kristallisiert es plättchenförmig aus. Die Löslichkeit in Wasser ist gering, dagegen ist es sehr gut löslich in Ethanol, Aceton, Diethylether und anderen typischen organischen Lösungsmitteln. Als organische Base ist es – unter Protonierung – auch in verdünnten Säuren gut löslich.
Als chemisches Analogon zu Pyridin ist Isochinolin eine schwache Base, mit einem pKb-Wert von 8,6. Es wird daher von starken Säuren, wie beispielsweise Salzsäure, leicht zu Salzen protoniert. Isochinolin bildet Addukte mit Lewis-Säuren, wie beispielsweise Bortrifluorid.
Verwendung
Für Isochinolin selbst gibt es kaum unmittelbare Anwendungen. Allerdings ist es ein wichtiges Zwischenprodukt für eine Reihe von wichtigen Isochinolinderivaten. Beispielhaft seien dabei genannt:
- Anästhetika wie Dimethisoquin.
- Blutdrucksenker wie Quinapril, Quinapirilat und Debrisoquin. Alles Derivate des 1,2,3,4-Tetrahydroisochinolins.
- Fungizide, wie 2,2'-Hexadecamethylendiisochinolindichlorid, das ebenso ein Antiseptikum ist.
- Desinfektionsmittel, wie N-Laurylisochinolinbromid
- Vasodilatatoren, wie beispielsweise Papaverin
Daneben finden Isochinolin-Derivate breite Anwendung bei der Herstellung von Farbstoffen, Insektiziden, Antimykotika und Korrosionsinhibitoren.
Isochinolin-Alkaloide
In der Natur sind über 600 Isochinolin-Alkaloide mit zum Teil sehr hoher biologischer Aktivität und pharmakologischer Wirksamkeit bekannt.[6]
Literatur
- T. L. Gilchrist: Heterocyclic Chemistry. 3. Auflage. Addison-Wesley Longman, Essex, UK 1997.
- J. Harris, W. J. Pope: isoQuinoline and the isoQuinoline-Reds. In: Journal of the Chemical Society. 121, 1922, S. 1029–1033, doi:10.1039/CT9222101029.
- A. R. Katritsky, A. F. Pozharskii: Handbook of Heterocyclic Chemistry. 2. Auflage. Elsevier, Oxford, UK 2000.
- A. R. Katritsky, C. W. Rees, E. F. Scriven (Hrsg.): Comprehensive Heterocyclic Chemistry II: A Review of the Literature 1982–1995. Vol. 5, Elsevier, Tarrytown, NY 1996.
- T. Nagatsu: Isoquinoline neurotoxins in the brain and Parkinson's disease. In: Neuroscience Research. 29, 1997, S. 99–111. PMID 9359458.
Weblinks
Einzelnachweise
- Eintrag zu Isochinolin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 29. Mai 2014.
- Datenblatt Isochinolin (PDF) bei Merck, abgerufen am 1. Oktober 2010.
- Brockhaus ABC Chemie. F. A. Brockhaus Verlag, Leipzig 1965, S. 594.
- Eintrag zu Isochinolin in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2018. (JavaScript erforderlich)
- ISOQUINOLINES (engl., PDF) In: Dr. Duke's Phytochemical and Ethnobotanical Database, Hrsg. U.S. Department of Agriculture, abgerufen am 18. Juli 2021.
- Chinolin – Alkaloide (Alkaloide aus Tryptophan). (Memento vom 29. Mai 2014 im Internet Archive) ein Script der Uni Jena, WS 2006, Naturstoffchemie.

