Permanganate
Permanganate (auch Tetraoxomanganate(VII)) sind Salze mit dem einfach negativ geladenen Anion MnO4−.
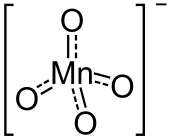
Struktur
Permanganate leiten sich von der nur in verdünnter wässriger Lösung beständigen Permangansäure mit der Summenformel HMnO4 ab. Permangansäure lässt sich im Vakuum bis etwa 20 % konzentrieren. Sie ist eine starke Säure mit einem pKs-Wert von −2,25.[1] Eine sehr reine Lösung der Permangansäure lässt sich unter anderem durch tropfenweisen Zusatz des zugrunde liegenden Anhydrids Mangan(VII)-oxid mit der Summenformel Mn2O7 zu einer großen Menge gut gekühlten Wassers erhalten.[2]
Salze
Wichtige Salze sind:
- Kaliumpermanganat KMnO4
- Calciumpermanganat Ca(MnO4)2
- Rubidiumpermanganat RbMnO4
- Magnesiumpermanganat Mg(MnO4)2
- Silberpermanganat AgMnO4
Eigenschaften
Die Permanganate sind wasserlöslich und bilden violette Lösungen, am bekanntesten ist das Kaliumpermanganat. Es sind starke Oxidationsmittel. Mit ihrer Hilfe können beispielsweise Alkene über die entsprechenden Glycole in Ketone oder Carbonsäuren überführt werden, Ameisen- und Oxalsäure in Kohlendioxid und Aldehyde in Carbonsäuren. Eine typische Reaktion des Permanganats als Oxidationsmittel ist die Oxidation konzentrierter Salzsäure zu Chlorgas, wobei das Permanganat selbst zu Mangan(II) reduziert wird:
Eisen(II)-sulfatlösung reagiert mit Permanganatlösung im Sauren zu Mangan(II)- und Eisen(III)-salzen, im Basischen zu Mangan(IV)-oxid (Braunstein).
In der Analytik werden Permanganate bei Redox-Titrationen eingesetzt, siehe Manganometrie.
Verwendung
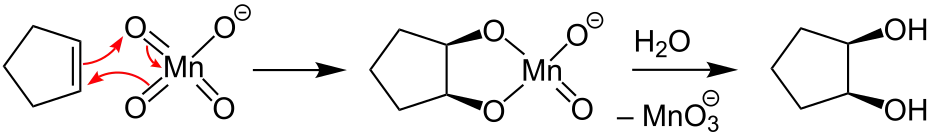
Permanganate werden auch zur Reinigung organischer Flüssigkeiten sowie der Abluft und der Abwässer in der pharmazeutischen und chemischen Industrie verwendet. Bei der Paraffinoxidation wurden Permanganate als Katalysatoren eingesetzt.[3] In der organischen Synthese wird Kaliumpermanganat mit Alkenen zu cyclischen Manganatestern umgesetzt. Bei der Aufarbeitung erhält man cis-1,2-Diole:[4]
Einzelnachweise
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1618.
- Gmelins Handbuch der anorganischen Chemie; Band Mangan C2.
- G. Wietzel: Herstellung synthetischer Fettsäuren durch Oxydation von paraffinischen Kohlenwasserstoffen mit molekularem Sauerstoff. In: Chemical Engineering Science. 3, 1954, S. 17–IN4, doi:10.1016/S0009-2509(54)80003-0.
- Joachim Buddrus, Bernd Schmidt: Grundlagen der Organischen Chemie, 5. Auflage, de Gruyter Verlag, Berlin, 2015, S. 186, ISBN 978-3-11-030559-3.