Ubichinol
Ubichinol (engl. Ubiquinol, auch Ubihydrochinon oder kurz QH2) ist eine elektronenreiche (reduzierte) Form des Coenzyms Q10. Die natürliche Ubichinolform des Coenzyms Q10 ist 2,3-Dimethoxy-5-methyl-6-polyprenyl-1,4-benzochinol, wobei die polyprenylierte Seitenkette bei Säugetieren 9–10 Einheiten und beim Menschen 10 Einheiten lang ist. Coenzym Q10 (CoQ10) existiert in drei Redoxzuständen, vollständig oxidiert (Ubichinon-10), teilweise reduziert (Semichinon oder Ubisemichinon), und vollständig reduziert (Ubichinol). Die Redoxfunktionen von Ubichinol in der zellulären Energieproduktion und im antioxidativen Schutz basieren auf der Fähigkeit, zwei Elektronen in einem Redoxzyklus zwischen Ubichinol (reduziert) und der (oxidierten) Ubichinon-Form auszutauschen.[4][5]
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
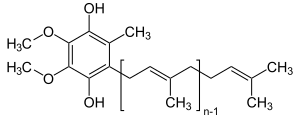 | ||||||||||||||||
| n = 9–10 (Säugetiere) bzw. 10 (Mensch) | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Ubichinol | |||||||||||||||
| Andere Namen | ||||||||||||||||
| Summenformel | C59H92O4 | |||||||||||||||
| Kurzbeschreibung |
weißes Pulver[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 865,36 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Vorkommen
Ubichinol ist ein fettlösliches Benzochinol, das in allen Zellsystemen gefunden wird und in praktisch jeder Zelle, jedem Gewebe und jedem Organ von Säugetieren. Ubichinol wird dem Körper durch Biosynthese, Nahrungsergänzung und, in kleinen Mengen, auch durch die Nahrung zugeführt. Ubichinol spielt eine wichtige Rolle als Schlüsselkomponente der Elektronentransportkette, durch die die Elektronen für die ATP-Synthase bereitgestellt werden. Bei Säugetieren findet die ATP-Produktion hauptsächlich in den Mitochondrien und – in geringerem Ausmaß – in anderen Organellen wie dem Golgi-Apparat oder dem endoplasmatischen Retikulum statt. Üblicherweise produzieren die Mitochondrien fast 95 % der für Zellwachstum und -entwicklung und einen gesunden Zellmetabolismus benötigten Energie. Die antioxidative Wirkung von Ubichinol wird inzwischen als eine der wichtigsten Funktionen in Zellsystemen angesehen. Ubichinol ist ein wirksames lipophiles Antioxidans, das in der Lage ist, andere Antioxidantien wie Vitamin E oder Vitamin C zu regenerieren. Jüngste Studien belegen außerdem die Funktion von Ubichinol bei der Genexpression, die in der Kommunikation, dem Metabolismus und Transport menschlicher Zellen zum Tragen kommt.[6][7][8][9]
Ubichinol in Nahrungsmitteln
In der Nahrung finden sich unterschiedliche Mengen von Ubichinol. Die Auswertung einer großen Bandbreite von Nahrungsmitteln zeigte, dass Ubichinol in 63 von 70 unterschiedlichen Produkten vorkam und 46 % der gesamten Coenzym-Q10-Aufnahme der japanischen Ernährung ausmachte.[10]
| Nahrungsmittel | Ubichinol (µg/g) | Ubichinon (µg/g) |
|---|---|---|
| Rindfleisch (Schulter) | 5,36 | 25 |
| Rindfleisch (Leber) | 40,1 | 0,4 |
| Schwein (Schulter) | 25,4 | 19,6 |
| Schwein (Schenkel) | 2,63 | 11,2 |
| Geflügel (Brust) | 13,8 | 3,24 |
| Makrele | 0,52 | 10,1 |
| Thunfisch (Dose) | 14,6 | 0,29 |
| Gelbschwanz | 20,9 | 12,5 |
| Broccoli | 3,83 | 3,17 |
| Petersilie | 5,91 | 1,57 |
| Orange | 0,88 | 0,14 |
Eigenschaften
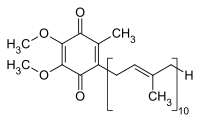
Ubichinol ist ein Benzochinol und eine reduzierte Form von Ubichinon, das auch Coenzym Q10 genannt wird.
Die Reduktion von Ubichinon zu Ubichinol findet in den Komplexen I und II der Elektronentransferkette statt. Der Q-Zyklus[11] ist ein Prozess, der mit Hilfe von Cytochrom c abläuft,[12][13] eine Komponente des Komplex III in der Elektronentransportkette, und welches Ubichinol in einem zyklischen Prozess in Ubichinon umwandelt. Wenn Ubichinol an Cytochrom c bindet, vermindert sich der pKa-Wert der phenolischen Gruppe, so dass das Proton ionisiert und das Phenoxidanion gebildet wird.
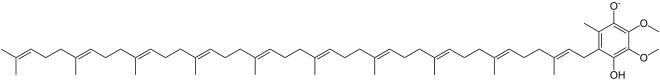
Wenn der Phenoxidsauerstoff oxidiert ist, bildet sich das Semichinon, wobei sich das ungepaarte Elektron im Ring befindet.
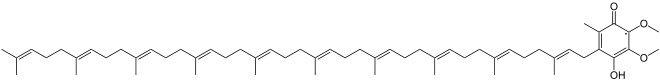
Bioverfügbarkeit
Es ist bekannt, dass Coenzym Q10 nicht gut vom Körper aufgenommen wird, so wie es in vielen begutachteten wissenschaftlichen Zeitschriften dargestellt worden ist.[14] Da seine Ubichinol-Form zwei zusätzliche Wasserstoffatome hat, führt dies zur Konversion von zwei Keton-Gruppen in Hydroxy-Gruppen auf dem aktiven Teil des Moleküls. Dies hat eine erhöhte Polarität des Coenzym-Q10-Moleküls zur Folge und könnte ein signifikanter Faktor bei der beobachteten stärkeren Bioverfügbarkeit von Ubichinol sein. Oral eingenommen zeigt Ubichinol eine größere Bioverfügbarkeit als Ubiquinon: 150 mg pro Tag in einer Softgel-Kapsel führten innerhalb von 4 Wochen zu Mindestblutwerten von 3,84 µg/g.[15]
Funktion
Die hauptsächliche Funktion von Ubichinol besteht in seiner Mitwirkung bei der Synthese von Zellenergie. Ubichinol findet sich in konzentrierter Form in der mitochondrialen Innenmembran, wo er als Träger von zwei Reduktionsäquivalenten pro Mol in den Komplexen I und II in Richtung des Komplexes III der mitochondrialen Elektronentransferkette dient. In diesem Prozess dient Ubichinol der Produktion von ATP (Adenosintriphosphat), des Hauptenergieträgers in lebenden Organismen.
Weiterhin fungiert Ubichinol als Akzeptor von Elektronen bei der Oxidation toxischen Schwefelwasserstoffs durch die Sulfid:Ubichinon-Oxidoreduktase. Auch diese Elektronen werden bei der ATP-Produktion benutzt.
Studien
Antioxidative Wirkung und Alterung
Ubichinol ist ein hochwirksames fettlösliches Antioxidans, das u. a. dazu in der Lage ist, α-Tocopherol zu regenerieren. Seine Bedeutung wird durch die Tatsache unterstrichen, dass es das einzige fettlösliche Antioxidans ist, das im Körper synthetisiert wird.[16] Wissenschaftler, die sich spezifisch mit Coenzym Q10 beschäftigen, haben den Zusammenhang zwischen suboptimalen Zuständen, die von hohem oxidativem Stress gekennzeichnet sind, und den entsprechenden Werten von Ubiquinon und Ubichinol im Körper untersucht – die beide zusammen einen Wert darstellen, der Gesamt-Coenzym Q10 genannt wird. Störungen, die durch erhöhten oxidativen Stress entstehen, können die Ubichinol- und Ubichinonwerte im Körper dramatisch verändern, ein Faktor, den die Wissenschaftler als das Verhältnis von Ubichinol zu Ubichinon ausdrücken (Ubichinol:Ubichinon). Eine andere Form der Darstellung ist das Ubichinol-Verhältnis, also der Prozentsatz von Ubichinol in der Gesamtmenge des Coenzym Q10. Eine signifikante Veränderung wurde z. B. im Coenzym-Q10-Profil von Diabetes-II-Patienten gefunden. Konkret wurde eine Abnahme des Plasma-Ubichinol-Verhältnisses festgestellt, was auf ein Ansteigen des oxidativen Stresses schließen lässt.[17] Eine andere Studie zeigte die Abnahme von Ubichinol unter Bedingungen erhöhten oxidativen Stresses. Patienten, die unter Hepatitis, Zirrhose und Hepatom litten, zeigten alle eine Abnahme ihrer Ubichinol-Konzentrationen, während die Werte des gesamten Coenzym Q10 (Ubichinol + Ubichinon) sich nicht verringerten.[18] Neuere Forschungen legen nahe, dass reduzierte Ubichinolwerte mit dem Altern zusammenhängen könnten. Ältere Menschen haben nicht nur eine verminderte Coenzym-Q10-Biosynthese, sondern auch eine reduzierte Fähigkeit, Ubichinon in Ubichinol umzuwandeln.[19]
Neuronale Gesundheit
Eine Anzahl kleinerer Studien hat gezeigt, dass Coenzym Q10 positiv auf das neurologische System wirkt. Eine Studie aus dem Jahre 2002 untersuchte die Wirkung von Coenzym Q10 (Ubiquinon) bei Patienten mit beginnender Parkinson-Krankheit. Die Wissenschaftler dieser Multi-Center-Phase-II–Studie fanden heraus, dass Ubiquinon die Funktionsminderung bei Parkinson verringerte.[20] Angesichts dieser ermutigenden Ergebnisse wurde anschließend eine weit größere Multi-Center-Phase-III–Studie auf den Weg gebracht. Eine weitere Studie untersuchte die schützende Wirkung von Ubichinon und Ubichinol bei Ratten, denen MPTP (1-Methyl-4-Phenyl-1,2,3,6-Tetrahydropyridin) verabreicht worden war, ein Neurotoxin, das Veränderungen wie bei idiopathischer Parkinson-Krankheit hervorruft. MPTP wirkt selektiv toxisch auf die Zellen der Substantia nigra, spezialisierte Zellen im Hirnstamm, die eine Rolle bei der motorischen Kontrolle und der Dopamin-Neurotransmitter-Synthese spielen. Beide Formen boten einen Schutz gegen MTPT-induzierte Toxizität, Ubichinol rief jedoch eine stärkere Wirkung hervor.[21]
Gesundheit der Nieren
Wissenschaftler der Universität Tokio haben die Rolle von Antioxidantien bei chronischen Nierenkrankheiten untersucht. Als Vorstudie wurde ein Tiermodell chronischer Nierenkrankheit entwickelt. Drei Versuchsgruppen wurden definiert: eine Kontrollgruppe, eine Gruppe mit hoch salzhaltiger Nahrung und eine Gruppe mit hoch salzhaltiger Nahrung plus Ubichinol. Im Vergleich zur Kontrollgruppe erhöhte die hoch salzhaltige Nahrung oxidativen Stress (gemessen an der Produktion von Superoxidanion im Nierengewebe), erhöhte den Blutdruck und rief Albuminurie hervor. Im Gegensatz dazu zeigte die Gruppe mit der hoch salzhaltigen Nahrung und Ubichinol-Ergänzung Ergebnisse, die auf eine erhebliche Schutzfunktion für die Nieren durch Ubichinol hinwiesen, einschließlich einer verminderten Produktion von Superoxidanion (antioxidative Wirkung), vermindertes Urinalbumin und eine Abnahme des Bluthochdrucks.[22]
Entzündungen und Genexpression
Es sind mehrere Studien initiiert worden, um die Wirkung von Coenzym Q10 auf die Genexpression zu untersuchen. So hat die computergestützte Analyse von Hunderten von Genen gezeigt, dass Coenzym Q10 auf 17 unterschiedliche Gene wirkt, die in ihrer Funktion durch 4 verschiedene zelluläre Verbindungswege verbunden sind: G-Protein gekoppelte Rezeptoren, den JAK-STAT-Signalweg, Integrin und Beta-Arrestin.[23] Die Forscher dieser Studie unternahmen anschließend detaillierte Untersuchungen mit der Ubichinol-Form. Eine In-vitro-Studie an einer menschlichen Monozytenzelllinie (THP-1), die Entzündung stimulierenden Lipopolysacchariden (LPS) ausgesetzt wurde, zeigte, dass Ubichinol die Freisetzung entzündungsfördernder Substanzen blockierte.[24] Die Wissenschaftler stellten fest, dass Ubichinol eine stärkere Wirkung auf diese Entzündungsauslöser hatte als Ubiquinon.
Weitere Forschungsergebnisse
Eine Studie untersuchte den Zusammenhang zwischen Ubichinol und Blutfetten bei Patienten mit koronarer Herzerkrankung. Dabei versuchten die Forscher herauszufinden, ob es einen Zusammenhang zwischen dem Ausmaß von Stenose (also der Verengung von Blutgefäßen) und den Konzentrationen von Ubichinol und Blutfetten gibt. Coenzym Q10 wird in Bezug auf Blutfette untersucht, weil es im Blut fast gänzlich in Lipoproteinen gefunden wird (besonders im Low Density Lipoprotein LDL-C).[25] Ihrerseits sind Lipoproteine Träger des fettlöslichen Cholesterins im Blutkreislauf (Cholesterin kommt nicht frei vor), daher also der Zusammenhang zwischen Coenzym Q10, Cholesterin und Lipoproteinen. Die Studienteilnehmer bekamen, im Gegensatz zu anderen Studien mit Nahrungsergänzung, kein Ubichinol und keine Statine. Um das Ausmaß von Stenose festzustellen, wurden die Probanden einer Angiographie der Herzkranzgefäße unterzogen. Von insgesamt 36 Probanden wurden 20 als negativ eingestuft (weniger als 50 % Stenose), 16 Probanden wurden als positiv klassifiziert (mehr als 70 % Stenose). Die Ergebnisse zeigten, dass der Quotient von Ubichinol zu Blutfetten in der Niedrig-Stenose-Gruppe signifikant höher war; im Gegensatz dazu wies die Hoch-Stenose-Gruppe signifikant niedrige Werte des Ubichinol/Blutfett-Quotienten auf.[26] Die Wissenschaftler hoben hervor, dass der Ubichinol/Blutfett-Quotient ein bedeutsamer Faktor für das Feststellen fortschreitender atherosklerotischer Veränderungen zu sein scheint. Auch wenn es sich hier nicht um eine Interventionsstudie handelte, trat der Zusammenhang zwischen dem Ubichinol/Blutfett-Quotienten und dem Ausmaß von Stenose klar zu Tage.
Weblinks
- Drehbare 3D-Strukturen von Komplex III auf Proteopedia.org
Einzelnachweise
- Patent US2008138326: Method for cancer treatment, carcinogenesis suppression or mitigation of adverse reactions of anticancer agents. Veröffentlicht am 12. Juni 2008, Erfinder: Fujii, Toshihide; Kato, Masanori; Sakamoto, Hirokazu; Shinagawa, Yoshiyuki; Kitano, Mitsuaki; Hosoe, Kazunori.
- Patent GB947643: Substituted chroman compounds. Veröffentlicht am 22. Januar 1964.
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- G. Lenaz et al.: Localization and mobility of coenzyme Q in lipid bilayers and membranes. In: Biofactors, 1999, 9, S. 87–93.
- M. Nakamura, T. Hayashi: One- and Two-electron reduction of quinones by rat liver subcellular fractions. In: J Biochem, 1994, 115, S. 334–344.
- M. Battino et al.: Natural distribution and occurrence of coenzyme Q homologues. In: Membr. Biochem., 1990, 9, S. 179–190.
- D. E. Green, Tzagoloff: The mitochondrial electron transfer chain. In: Arch. Biochem. Biophys., 1966, 116, S. 293–304.
- B. Frei et al.: Ubiquinol-10 is an effective lipid-soluble antioxidant at physiological concentrations. In: Proc. Natl. Acad. Sci. USA, 1990, 87, S. 4879–4883.
- A. Arroyo et al.: Ubiquinol regeneration by plasma membrane ubiquinone reductase. In: Protoplasma, 1998, 205, S. 107–113.
- H Kubo et al.: Food Content of ubiquinol-10 and ubiquinone-10 in the Japanese diet. In: Journal of Food Composition and Analysis, 2008, 21, S. 199–210, doi:10.1016/j.jfca.2007.10.003.
- E. C. Slater: The Q cycle: An ubiquitous mechanism of electron transfer. In: Trends in Biochemical Sciences, 1983, 8, S. 239–242.
- B. L. Trumpower: Cytochrome bc1 complexes of microorganisms. In: Microbiological Reviews, 1990, 54, S. 101–129.
- B. L. Trumpower: The protonmotive Q cycle-energy transduction by coupling of proton translocation to electron transfer by the cytochrome bc1 complex. In: J. Biol. Chem., 1990, 265, S. 11409–11412.
- AM James et al.: Interactions of Mitochondria-targeted and Untargeted Ubiquinones with the Mitochondrial Respiratory Chain and Reactive Oxygen Species. In: Journal of Biochemistry. 2005, 280 (22), S. 21295–21312, PMID 15788391.
- K Hosoe et al.: Study On Safety And bioavailability of ubiquinol (Kaneka QH) after single and 4-week multiple oral administration to healthy volunteers. In: Regulatory Toxicology and Pharmacology, 2007, 47, S. 19–28, PMID 16919858.
- P Navas et al.: The importance of plasma membrane coenzyme Q in aging and stress response. In: Mitochondrion, 2007, 7S, S34–S40.
- S Lim et al.: Oxidative burden in prediabetic and diabetic individuals: evidence from plasma coenzyme Q10. In: Diabetic Medicine, 2006, 23, S. 1344–1349.
- Y Yamamoto et al.: Plasma ubiquinone to ubiquinol ratio in patients with hepatitis, cirrhosis, and hepatoma, and in patients with percutaneous transluminal coronary reperfusion. In: BioFactors, 1999, 9, S. 241–246.
- H Wada et al.: Redox Status Of Coenzyme Q10 Is Associated With Chronological Age. In: Journal of the American Geriatrics Society, 2007, 55(7), S. 1142–1144.
- C Shults et al.: Effects of Coenzyme Q10 in Early Parkinson Disease. In: Archives of Neurology, 2002, 59 S. 1541–1550.
- C Cleren et al.: Therapeutic effects of coenzyme Q10 (CoQ10) and reduced CoQ10 in the MPTP model of Parkinsonism. In: Journal of Neurochemistry, 2008, 104, S. 1613–1621.
- A Ishikawa et al.: Renal preservation effect of ubiquinol, the reduced form of coenzyme Q10. In: Clin Exp Nephrol., 2010.
- F Döring et al.: Functional Connections and Pathways of Coenzyme Q10-inducible Genes: An In-silico Study. In: IUBMB Life, 2007, 59(10), S. 628–633.
- C Schmelzer et al.: In vitro effects of the reduced form of Coenzyme Q10 on secretion levels of TNF-alpha and chemokines in response to LPS in the human monocytic cell line THP-1. In: J Clin Biochem Nutr., 2009, 44, S. 62–66.
- MV. Miles: The uptake and distribution of coenzyme Q(10). In: Mitochondrion, 2007, S72–S77.
- P Zakova et al.: Ubiquinol-10/lipids ratios in consecutive patients with different angiographic findings. In: Clinica Chimica Acta, 2007, 380, S. 133–138.