Hauserbasen
Bei Hauserbasen, auch als Magnesiumamidbasen bezeichnet, handelt es sich um Magnesiumverbindungen, die in der organischen Chemie als Basen für Metallierungsreaktionen verwendet werden und erstmals 1947 von Charles R. Hauser beschrieben worden sind.[1] Im Vergleich zu lithiumorganischen Verbindungen haben diese Verbindungen kovalentere und damit weniger reaktive Metall–Ligand-Bindungen. Das führt in der Konsequenz zu einer höheren Toleranz gegenüber funktionellen Gruppen und einer deutlich höheren Chemoselektivität.[2] Außerdem können Hauserbasen für Reaktionen bei Raumtemperatur genutzt werden, wohingegen Reaktionen mit lithiumorganischen Verbindungen tendenziell bei tiefen Temperaturen, für gewöhnlich −78 °C, durchgeführt werden.
Struktur
Festkörperstruktur
Wie alle Grignard-Dimere[3] sind die von 2,2,6,6-Tetramethylpiperidin (TMP)[4] und Hexamethyldisilazan (HMDS)[5] abgeleiteten Hauserbasen im Festkörper durch die Halogene verbrückt. Im Gegensatz zu Gringnardverbindungen existieren allerdings auch amidoverbrückte Hauserbasen. Dabei haben alle gemeinsam, dass sie durch sterisch weniger anspruchsvolle Amidoliganden wie Et2N−,[6] Ph3P=N−[7] oder iPr2N−[8] verbrückt sind. Der Austausch der Halogenbrücken hängt dabei wahrscheinlich mit dem sterischen Anspruch der Amidliganden zusammen.
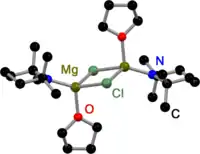 TMP-basierte Hauserbase im Festkörper |
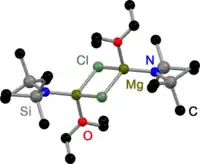 HMDS-basierte Hauserbase im Festkörper |
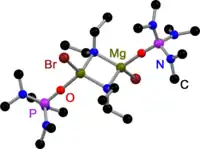 Diethylamido-verbrückte Hauserbase im Festkörper |
Struktur in Lösung
Obwohl über die Möglichkeiten der Verwendung von Hauserbasen viel bekannt ist, ist über ihr Verhalten in Lösung nur wenig bekannt. Ein Grund dafür liegt in dem komplexen Verhalten, dass sie in Lösung zeigen. Ein Vorschlag lautete, dass Ähnlichkeiten zum Schlenk-Gleichgewicht der Gringnardreagenzen gibt, bei denen mehr als eine magnesiumhaltige Spezies existiert.[9] 2016 konnten Neufeld et al. durch DOSY-NMR-Experimente[10] ein solches schlenkartiges Verhalten nachweisen:[11]
Das Gleichgewicht zeigt dabei eine hohe Temperaturabhängigkeit. So liegt bei hohen Temperaturen hauptsächlich die heteroleptische Spezies vor, bei niedrigen Temperaturen hingegen die homoleptischen Spezies. Außerdem finden sich in der THF-Lösung dimere Spezies, die durch Chloride und Amide verbrückt werden, obwohl Alkylmagnesiumchloride dort nicht dimerisieren. Bei niedrigen Temperaturen und einem Überschuss an Magnesiumchlorid finden sich in der Lösung außerdem noch MgCl2-co-koordinierende Spezies.[12]
Verwendung
Im Allgemeinen werden Hauserbasen genau wie Organolithiumverbindungen oder Metallamide als Metallierungsreagenzien verwendet. Der Durchbruch von Synthesevorschriften mit Hauserbasen erfolgte dabei in den 1980er und 1990er Jahren. Eaton und seine Mitarbeiter konnten zeigten, dass iPr2NMgBr selektiv in Orthoposition Magnesiatcarboxamide bildet.[13]
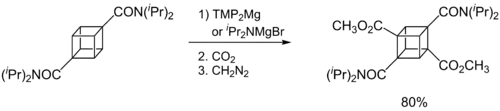
Später zeigten Kondo, Sakamo und ihre Mitarbeiter, dass iPr2NMgX (X= Cl, Br) als selektives Deprotonierungsreagenz (nur an der 2-Position) für heterocyclische Thiophene[14] und phenylsulphonylsubstituierte Indole dient.[15]
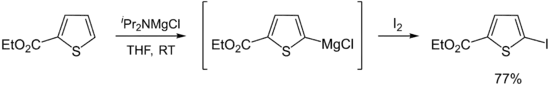
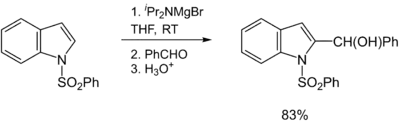
Ein großer Nachteil von Hauserbasen liegt in ihrer schlechten Löslichkeit in THF. In der Konsequenz ist die Metallierungsgeschwindigkeit gering und es wird ein großer Überschuss an Base benötigt (meistens 10 Äquivalente). Dieser Umstand verkompliziert die Funktionalisierung des metallierten Intermediats als Elektrophil. Die Löslichkeit und damit auch die Reaktivität kann allerdings durch das Zufügen von stöchiometrischen Mengen Lithiumchlorid erreicht werden. Diese sogenannten Turbo-Hauserbasen wie TMPMgCl·LiCl and iPr2NMgCl·LiCl sind teilweise kommerziell erhältlich[16] und zeigen eine erhöhte kinetische Basizität, eine exzellente Regioselektivität und eine hohe Toleranz gegenüber funktionellen Gruppen bei vielen aromatischen und heteroaromatischen Substraten.[17][18]
Darstellung
Hauserbasen können durch die Mischung eines Amines mit einer Grignardreagenz hergestellt werden (X = Cl, Br, I):
Kommerziell erhältliche Hauserbasen
iPr2NMgX
TMPMgX (TMP = 2,2,6,6,Tetramethylpiperidino)
X = Cl, Br
Siehe auch
Einzelnachweise
- Charles R. Hauser, Howard G. Walker: Condensation of Certain Esters by Means of Diethylaminomagnesium Bromide 1,2. In: Journal of the American Chemical Society. Band 69, Nr. 2, Februar 1947, ISSN 0002-7863, S. 295–297, doi:10.1021/ja01194a040.
- Robert Li-Yuan Bao, Rong Zhao, Lei Shi: Progress and developments in the turbo Grignard reagent i-PrMgCl·LiCl: a ten-year journey. In: Chemical Communications. Band 51, Nr. 32, 2015, ISSN 1359-7345, S. 6884–6900, doi:10.1039/C4CC10194D.
- Ömer Seven, Michael Bolte, Hans-Wolfram Lerner: Di-μ-bromido-bis[(diethyl ether-κ O )(2,4,6-trimethylphenyl)magnesium]: the mesityl Grignard reagent. In: Acta Crystallographica Section E Structure Reports Online. Band 69, Nr. 7, 15. Juli 2013, ISSN 1600-5368, S. m424–m424, doi:10.1107/S1600536813017108, PMID 24046588, PMC 3772445 (freier Volltext).
- Pablo García-Álvarez, David V. Graham, Eva Hevia, Alan R. Kennedy, Jan Klett: Unmasking Representative Structures of TMP-Active Hauser and Turbo-Hauser Bases. In: Angewandte Chemie International Edition. Band 47, Nr. 42, 6. Oktober 2008, S. 8079–8081, doi:10.1002/anie.200802618.
- Kuo-Ching Yang, Chung-Cheng Chang, Jyh-Yuan Huang, Chih-Chien Lin, Gene-Hsiang Lee: Synthesis, characterization and crystal structures of alkyl-, alkynyl-, alkoxo- and halo-magnesium amides. In: Journal of Organometallic Chemistry. Band 648, Nr. 1-2, April 2002, S. 176–187, doi:10.1016/S0022-328X(01)01468-1 (elsevier.com [abgerufen am 26. Oktober 2019]).
- Pablo García-Álvarez, David V. Graham, Eva Hevia, Alan R. Kennedy, Jan Klett: Unmasking Representative Structures of TMP-Active Hauser and Turbo-Hauser Bases. In: Angewandte Chemie International Edition. Band 47, Nr. 42, 6. Oktober 2008, S. 8079–8081, doi:10.1002/anie.200802618.
- Andrei S. Batsanov, Philip D. Bolton, Royston C.B. Copley, Matthew G. Davidson, Judith A.K. Howard: The metallation of imino(triphenyl)phosphorane by ethylmagnesium chloride: The synthesis, isolation and X-ray structure of [Ph3P=NMgCl·O=P(NMe2)3]2. In: Journal of Organometallic Chemistry. Band 550, Nr. 1-2, Januar 1998, S. 445–448, doi:10.1016/S0022-328X(97)00550-0.
- David R. Armstrong, Pablo García-Álvarez, Alan R. Kennedy, Robert E. Mulvey, John A. Parkinson: Diisopropylamide and TMP Turbo-Grignard Reagents: A Structural Rationale for their Contrasting Reactivities. In: Angewandte Chemie International Edition. Band 49, Nr. 18, 19. April 2010, S. 3185–3188, doi:10.1002/anie.201000539.
- Neufeld, Roman.: DOSY External Calibration Curve Molecular Weight Determination as a Valuable Methodology in Characterizing Reactive Intermediates in Solution. In: eDiss, Georg-August-Universität Göttingen. 2016.
- Roman Neufeld, Dietmar Stalke: Accurate molecular weight determination of small molecules via DOSY-NMR by using external calibration curves with normalized diffusion coefficients. In: Chemical Science. Band 6, Nr. 6, 2015, ISSN 2041-6520, S. 3354–3364, doi:10.1039/C5SC00670H, PMID 29142693, PMC 5656982 (freier Volltext).
- Roman Neufeld, Thorsten L. Teuteberg, Regine Herbst-Irmer, Ricardo A. Mata, Dietmar Stalke: Solution Structures of Hauser Base i Pr 2 NMgCl and Turbo -Hauser Base i Pr 2 NMgCl·LiCl in THF and the Influence of LiCl on the Schlenk-Equilibrium. In: Journal of the American Chemical Society. Band 138, Nr. 14, 13. April 2016, ISSN 0002-7863, S. 4796–4806, doi:10.1021/jacs.6b00345.
- Roman Neufeld, Thorsten L. Teuteberg, Regine Herbst-Irmer, Ricardo A. Mata, Dietmar Stalke: Solution Structures of Hauser Base i Pr 2 NMgCl and Turbo -Hauser Base i Pr 2 NMgCl·LiCl in THF and the Influence of LiCl on the Schlenk-Equilibrium. In: Journal of the American Chemical Society. Band 138, Nr. 14, 13. April 2016, ISSN 0002-7863, S. 4796–4806, doi:10.1021/jacs.6b00345.
- Philip E. Eaton, Chih Hung Lee, Yusheng Xiong: Magnesium amide bases and amido-Grignards. 1. Ortho magnesiation. In: Journal of the American Chemical Society. Band 111, Nr. 20, September 1989, ISSN 0002-7863, S. 8016–8018, doi:10.1021/ja00202a054.
- Manabu Shilai, Yoshinori Kondo, Takao Sakamoto: Selective metallation of thiophene and thiazole rings with magnesium amide base. In: Journal of the Chemical Society, Perkin Transactions 1. Nr. 4, 2001, S. 442–444, doi:10.1039/b007376h.
- Yoshinori Kondo, Akihiro Yoshida, Takao Sakamoto: Magnesiation of indoles with magnesium amide bases. In: Journal of the Chemical Society, Perkin Transactions 1. Nr. 19, 1996, ISSN 0300-922X, S. 2331, doi:10.1039/p19960002331.
- New Reagents for Selective Metalation, Deprotonation, and Additions. Abgerufen am 26. Oktober 2019 (englisch).
- David Tilly, Floris Chevallier, Florence Mongin, Philippe C. Gros: Bimetallic Combinations for Dehalogenative Metalation Involving Organic Compounds. In: Chemical Reviews. Band 114, Nr. 2, 22. Januar 2014, ISSN 0009-2665, S. 1207–1257, doi:10.1021/cr400367p.
- Thomas Klatt, John T. Markiewicz, Christoph Sämann, Paul Knochel: Strategies To Prepare and Use Functionalized Organometallic Reagents. In: The Journal of Organic Chemistry. Band 79, Nr. 10, 16. Mai 2014, ISSN 0022-3263, S. 4253–4269, doi:10.1021/jo500297r.