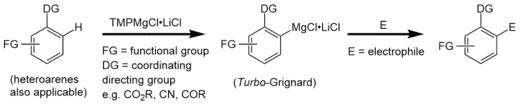
Turbo-Hauserbasen
Bei Turbo-Hauserbasen handelt es sich um Magnesiumamidhalogenide (Hauserbasen), die stöchiometrische Mengen Lithiumchlorid enthalten. Diese gemischten Mg/Li-Amide des Typs R2NMgCl⋅LiCl finden in der organischen Chemie als nicht-nucleophile Basen für Metallierungsreaktionen an aromatischen und heteroaromatischen Substraten Verwendung. Verglichen mit ihren lithiumchloridfreien Vorfahren haben Turbo-Hauserbasen eine erhöhte kinetische Basizität, exzellente Regioselektivität, hohe Toleranz gegenüber funktionellen Gruppen und eine bessere Löslichkeit.[1][2]
Darstellung
Typischerweise werden Turbo-Hauserbasen durch die Reaktion eines Amins mit einer Grignardreagenz oder durch Mischen eines Lithiumamids mit stöchiometrischen Mengen MgCl2 hergestellt.
Zu den gebräuchlichsten Turbo-Hauserbasen gehören iPr2NMgCl·LiCl (iPr-Turbo-Hauserbase) und TMPMgCl·LiCl (TMP-Turbo-Hauserbase, auch als Knochel-Hauserbase bezeichnet[3] (TMP = 2,2,6,6,Tetramethylpiperidino)).
Struktur
Bisher sind noch nicht viele Strukturen von Turbo-Hauserbasen bekannt. Generell lässt sich allerdings sagen, dass sie in Lösung eine komplexe Temperatur- und Konzentrationsabhängigkeit aufweisen.[4] Aus diesem Grund ist es nicht einfach Hauserbasen und ihre Turbo-Varianten zu kristallisieren.
Festkörperstruktur
Die iPr-Turbo-Hauserbase kristallisiert als dimeres, amidoverbrücktes Kontaktionenpaar.[5] Der TMP-Ligand hat hingegen einen höheren sterischen Anspruch, was die Dimerisierung hindert. Aus diesem Grund kristallisiert die TMP-Turbo-Hauserbase als monomeres Kontaktionenpaar.[6] In beiden Fällen koordiniert das Lithiumchlorid an das Magnesiumamid.
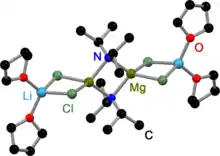 iPr-Turbo-Hauserbase im Festkörper |
 TMP-Turbo-Hauserbase im Festkörper |
Struktur in Lösung
Obwohl der Einsatz von Turbo-Hauserbasen gut bekannt ist, hält sich das Wissen über ihr Verhalten in Lösung in Grenzen. Ein Grund für diesen Informationsmangel liegt in dem komplexen Verhalten, dass sie in Lösung zeigen.[4] 2016 konnten Neufeld et al. mittels Diffusion-Ordered Spectroscopy (DOSY)[7] zeigen, dass bei Raumtemperaturen und hohen Konzentrationen (0.6 M) auch in Lösung die dimere Festkörperstruktur [iPr2NMgCl·LiCl]2 vorliegt.[8] Bei niedrigeren Konzentrationen liegt das Gleichgewicht hingegen auf der Seite der monomeren Spezies. Sowohl die monomere als auch die dimere Spezies zeigen eine co-Koordiation des Lithiumchlorids. Bei Temperaturen von unter −50 °C wird das Lithiumchlorid vom Magnesiumamid abgespalten, sodass ein stabiles [LiCl]2-Dimer vorliegt, das von vier THF-Molekülen solvatisiert wird.[9]
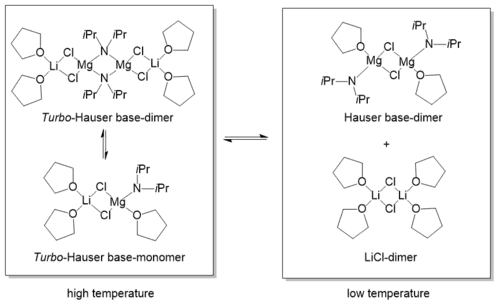
Bei der TMP-Turbo-Hauserbase liegt in THF-Lösung hingegen unabhängig von der Konzentration und der Temperatur fast vollständig die Festkörperstruktur vor. Aufgrund des hohen sterischen Anspruchs der TMP-Liganden und seiner flexiblen Rotation in Lösung wird das THF-Molekül vom Magnesiumkation abgespalten, was zu einer freien Koordinationsstelle an selbigem führt und die erhöhte Reaktivität und Selektivität von TMPMgCl·LiCl erklären könnte.[10]

Knochel et al. haben vorgeschlagen, dass das Lithiumchlorid die Reaktivität von Turbo-Grignard des Typs RMgCl·LiCl (R = Alkyl, Aryl or Vinyl) dadurch erhöhen, dass sie dem reaktiven bimetallischen Monomer einen Magnesiatcharakter im Sinne eines lösungsmittelgetrennten Ionenpaars [Li(THF)4]+ [RMg(THF)Cl2]− geben.[1][11] Im Falle der oben genannten Turbo-Hauserbasen, in denen die Alkylgruppe der Grignardreagenz durch eine Amidogruppe (R = R'2N−) ersetzt wurde, konnte diese Hypothese allerdings nicht bestätigt werden, da [Li(THF)4]+ nicht beobachtet wurde.[12]
Reaktivität
Im Gegensatz zu Turbo-Grignardverbindungen, die für hocheffiziente Br/Mg Austauschreaktionen verwendet werden,[13] finden Turbo-Hauserbasen als effektive Deprotonierungsreagenz von funktionalisierten Aromaten Verwendung.[1] Nach der Deprotonierung kann das intermediäre Produkt (ein Turbo-Grignard) selektiv durch die Zufuhr eines Elektrophils (zum Beispiel I2 oder -CHO) funktionalisiert werden.


Turbo-Hauserbasen werden genau wie lithiumorganische Verbindungen als Metallierungs- und Deprotonierungsreagenzien verwendet. Viele lithiierte Verbindungen sind allerdings nur bei tiefen Temperaturen (zum Beispiel −78 °C) stabil oder es kann zu konkurrierenden Additionsreaktionen wie der Tschitschibabin-Reaktion kommen. Im Gegensatz dazu haben die Magnesiumverbindungen kovalentere und dadurch weniger reaktive Metall-Ligand-Bindungen. Außerdem wird der gesamte Magnesium-Amid-Komplex durch das Lithiumchlorid stabilisiert. Das führt bei Turbo-Hauserbasen zu einer höheren Toleranz gegenüber funktionellen Gruppen und einer höheren Chemoselektivität bei hohen und niedrigen Temperaturen.[14]
iPr2NMgCl·LiCl zeigt im Vergleich zu TMPMgCl·LiCl teilweise eine unterschiedliche Reaktivität. So zeigten Armstrong et al., dass die TMP-Turbo-Hauserbase Ethyl-3-chlorobenzoat problemlos in der C2-Position metalliert, wohingegen die gleiche Reaktion mit der iPr-Turbo-Hauser zu keiner Metallierung führt. Im Gegensatz dazu kommt es zu einer Additions-Eliminierungsreaktion.[5]
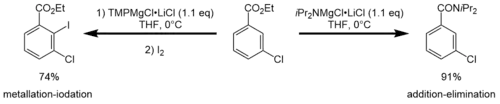
Ein anderer Unterschied konnte von Krasovskiy et al. bei der Deprotonierung von Isochinolin in einer THF-Lösung gezeigt werden. Während die Reaktion mit iPr2NMgCl·LiCl 12 Stunden und 2 Äquivalente der Turbo-Hauserbase benötigt, benötigt die Reaktion mit TMPMgCl·LiCl nur zwei Stunden und 1.1 Äquivalente.[1]
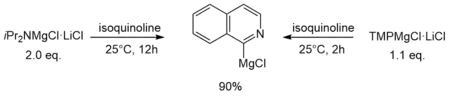
Auf der einen Seite lässt sich die unterschiedliche Reaktivität auf die höhere kinetische Basizität der TMP-Verbindung gegenüber der homologen iPr-Turbo-Hauserbase erklären. Auf der anderen Seite spielt wahrscheinlich auch das unterschiedliche Verhalten der beiden Verbindungen in Lösung eine Rolle (siehe vorheriges Kapitel). So zeigen in der Organolithiumchemie monomere Spezies die höchste kinetische Aktivität. Das könnte analog erklären, warum die monomere TMP-Turbo-Hauserbase deutlich schneller reagiert als die dimere iPr-substituierte.
Neufeld et al. haben zusätzlich vorgeschlagen, dass die hohe Regioselektivität der von ortho-Deprotonierungesreaktionen bei TMPMgCl·LiCl mit der räumlichen Nähe in dem Übergangszustandskomplex zwischen dem bimetallischen Aggregat und dem funktionalisierten (hetero)aromatischen Substrat zusammenhängt.[10]

Einzelnachweise
- Arkady Krasovskiy, Valeria Krasovskaya, Paul Knochel: Mixed Mg/Li Amides of the Type R2NMgCl⋅LiCl as Highly Efficient Bases for the Regioselective Generation of Functionalized Aryl and Heteroaryl Magnesium Compounds. In: Angewandte Chemie International Edition. Band 45, Nr. 18, 28. April 2006, ISSN 1433-7851, S. 2958–2961, doi:10.1002/anie.200504024.
- New Reagents for Selective Metalation, Deprotonation, and Additions. Abgerufen am 27. Oktober 2019 (englisch).
- 2,2,6,6-Tetramethylpiperidinylmagnesium chloride lithium chloride complex solution 703540. Abgerufen am 27. Oktober 2019.
- Neufeld, R.: DOSY External Calibration Curve Molecular Weight Determination as a Valuable Methodology in Characterizing Reactive Intermediates in Solution. In: eDiss, Georg-August-Universität Göttingen. 2016.
- David R. Armstrong, Pablo García-Álvarez, Alan R. Kennedy, Robert E. Mulvey, John A. Parkinson: Diisopropylamide and TMP Turbo-Grignard Reagents: A Structural Rationale for their Contrasting Reactivities. In: Angewandte Chemie International Edition. Band 49, Nr. 18, 19. April 2010, S. 3185–3188, doi:10.1002/anie.201000539.
- Pablo García-Álvarez, David V. Graham, Eva Hevia, Alan R. Kennedy, Jan Klett: Unmasking Representative Structures of TMP-Active Hauser and Turbo-Hauser Bases. In: Angewandte Chemie International Edition. Band 47, Nr. 42, 6. Oktober 2008, S. 8079–8081, doi:10.1002/anie.200802618.
- Roman Neufeld, Dietmar Stalke: Accurate molecular weight determination of small molecules via DOSY-NMR by using external calibration curves with normalized diffusion coefficients. In: Chemical Science. Band 6, Nr. 6, 2015, ISSN 2041-6520, S. 3354–3364, doi:10.1039/C5SC00670H, PMID 29142693, PMC 5656982 (freier Volltext).
- Roman Neufeld, Thorsten L. Teuteberg, Regine Herbst-Irmer, Ricardo A. Mata, Dietmar Stalke: Solution Structures of Hauser Base i Pr 2 NMgCl and Turbo -Hauser Base i Pr 2 NMgCl·LiCl in THF and the Influence of LiCl on the Schlenk-Equilibrium. In: Journal of the American Chemical Society. Band 138, Nr. 14, 13. April 2016, ISSN 0002-7863, S. 4796–4806, doi:10.1021/jacs.6b00345.
- Hans J. Reich, Joseph P. Borst, Robert R. Dykstra, Patrick D. Green: A nuclear magnetic resonance spectroscopic technique for the characterization of lithium ion pair structures in THF and THF/HMPA solution. In: Journal of the American Chemical Society. Band 115, Nr. 19, September 1993, ISSN 0002-7863, S. 8728–8741, doi:10.1021/ja00072a028.
- Roman Neufeld, Dietmar Stalke: Solution Structure of Turbo-Hauser Base TMPMgCl⋅LiCl in [D 8 ]THF. In: Chemistry – A European Journal. Band 22, Nr. 36, 26. August 2016, S. 12624–12628, doi:10.1002/chem.201601494.
- Arkady Krasovskiy, Bernd F. Straub, Paul Knochel: Highly Efficient Reagents for Br/Mg Exchange. In: Angewandte Chemie International Edition. Band 45, Nr. 1, Januar 2006, ISSN 1433-7851, S. 159–162, doi:10.1002/anie.200502220.
- Chao Feng, Drew W. Cunningham, Quinn T. Easter, Suzanne A. Blum: Role of LiCl in Generating Soluble Organozinc Reagents. In: Journal of the American Chemical Society. Band 138, Nr. 35, 7. September 2016, ISSN 0002-7863, S. 11156–11159, doi:10.1021/jacs.6b08465.
- Arkady Krasovskiy, Paul Knochel: A LiCl-Mediated Br/Mg Exchange Reaction for the Preparation of Functionalized Aryl- and Heteroarylmagnesium Compounds from Organic Bromides. In: Angewandte Chemie International Edition. Band 43, Nr. 25, 21. Juni 2004, ISSN 1433-7851, S. 3333–3336, doi:10.1002/anie.200454084.
- Robert Li-Yuan Bao, Rong Zhao, Lei Shi: Progress and developments in the turbo Grignard reagent i-PrMgCl·LiCl: a ten-year journey. In: Chemical Communications. Band 51, Nr. 32, 2015, ISSN 1359-7345, S. 6884–6900, doi:10.1039/C4CC10194D.