Graphenoxid
Graphenoxid (GO) ist ein kohlenstoffbasiertes 2D-Nanomaterial, das in der Regel durch die Reaktion von Graphit mit einem starken Oxidationsmittel und anschließender wässriger Aufarbeitung hergestellt wird.[1][2][3][4][5][6][7] Es ist aus einem ausgedehnten hexagonalen Kohlenstoff-Grundgerüst aufgebaut, welches eine variable Menge an Punkt- und ausgedehnten Lochdefekten innerhalb der Kohlenstoff-Ebene besitzt. Dieses Kohlenstoffgitter ist auf beiden Seiten sowie dem Rand mit sauerstoffhaltigen funktionellen Gruppen dekoriert.[8][7] Dieses Material ist ein vielversprechendes Ausgangsmaterial für die Massenherstellung von Graphen. Der Name Graphenoxid ist der Grundterminus für sämtliche monolagigen Graphen-Derivate mit sauerstoffhaltigen funktionellen Gruppen, während multilagiges Graphenoxid hingegen als Graphitoxid bezeichnet wird.

Herstellung
Für die Herstellung von Graphenoxid aus Graphit gibt es aus historischen Gründen kein einheitliches Protokoll. Zwar sind die zugrunde liegenden Reaktionen zur Gewinnung der „Graphitsäure“ (Brodie 1859, Staudenmaier 1898, Charpy 1909 und Hofmann 1937) seit vielen Jahrzehnten bekannt, allerdings wurde die laminare Natur und somit die mögliche Exfoliation von Graphitoxid zu Graphenoxid erst weitaus später herausgefunden.[2][9][10][11] Die aktuell am meisten verwendete Methode der Darstellung basiert auf der Methode von William S. Hummers und Richard E. Offeman (1958), da diese einfach durchzuführen ist und relativ ungefährliche Chemikalien verwendet werden.[4] Je nach Methode variieren die Ausbeute, der Funktionalisierungsgrad des sp2-Gitters, die Anzahl der eingeführten Lochdefekte und somit die letztendliche Qualität des erhaltenen Graphenoxids stark.[12]
Zur Gewinnung wird im Allgemeinen zunächst fein gemahlener Graphit mit hoher Kristallinität in einer stark konzentrierten und oxidierend wirkenden Säure dispergiert. Meistens handelt es sich hierbei um Schwefelsäure, Salpetersäure, oder Mischungen dieser – in seltenen Fällen um ortho-Phosphorsäure. Wichtig ist schon hier die Auswahl des richtigen Graphits, da sie einen maßgeblichen Einfluss auf die Qualität des am Ende erhaltenen Graphenoxids hat. Anschließend wird unter stetigem Rühren, teilweise unter Kühlung, ein weiteres Oxidationsmittel vorsichtig hinzugefügt (z. B. KMnO4, KClO3, (NH4)2S2O8, NaNO3). Die reaktive Spezies ist im Falle von Permanganat (Methode nach Hummers und Offeman) das durch seine Dehydratisierung in-situ gebildete Manganyl-Kation (MnO3+) bzw. Dimanganheptoxid.[13][14]
Das Oxidationsmittel beginnt die einzelnen Graphenschichten bis zu einem theoretischen Ladungsmaximum von C30+ zu oxidieren, wobei zum Ladungsausgleich gleichzeitig Schwefelsäure und Hydrogensulfat-Anionen zwischen die Graphenlagen interkalieren.[15][16] Es entsteht eine acceptor-type Graphit-Interkalationsverbindung als Intermediat (vgl. Lithium-Ionen-Batterie, donor-type). Der Schichtabstand erhöht sich durch den Prozess der Interkalation von 0.332 nm in Graphit auf ~ 0.9 nm in der Interkalationsverbindung.[15][16][17] Eine anschließende wässrige Aufarbeitung führt zur Entstehung von Graphitoxid.[18] Der genaue Mechanismus der Funktionalisierung ist komplex und trotz intensiver Forschung bislang nicht endgültig im Detail aufgeklärt.[14] Das final erhaltene Graphitoxid kann schon in neutralen oder leicht alkalischen wässrigen Lösungen bei einem hinreichend hohen Funktionalisierungsgrad von selbst in Graphenoxid delaminieren. Dieser langsame Prozess kann allerdings durch Ultraschall, Kugelmühlen oder durch Jet-Kavitation beschleunigt werden. Nach weiteren Aufreinigungsschritten – gewöhnlich durch Zentrifugation oder Filtration – erhält man eine goldgelbe Dispersion von Graphenoxid in Wasser.[18] Eine vorherige Zugabe von Wasserstoffperoxid dient der Transformation diverser unlöslicher Manganspezies in wasserlösliche Mn2+ Ionen und erleichtert somit die Aufreinigung.
Struktur

Die übergeordnete Struktur des Graphenoxids ist das Graphitoxid, aus dem es durch Delaminierung mit z. B. Ultraschall oder Kugelmühlen gewonnen wird. Die Partikelgröße der einzelnen Graphenoxid-Teilchen in einer Dispersion ist heterogen verteilt und hängt stark vom anfänglich verwendeten Graphit ab. Sie liegt nach der Herstellung üblicherweise im Bereich von wenigen Mikrometern, meist im Bereich von 5-20 μm und kann durch diverse Nachbehandlungstechniken im Nachhinein verringert werden.
Eine Monolage Graphenoxid besteht aus einem hexagonalen Kohlenstoff-Gerüst und ist beidseitig mit sauerstoffhaltigen funktionellen Gruppen dekoriert (on-plane functional groups), die durch Oxidation des Graphits eingeführt wurden.[7][19][20] Je nach Syntheseprotokoll variiert die Zusammensetzung der funktionellen Gruppen teils drastisch, kann aber auf folgende Typen eingegrenzt werden: Hydroxyle (-OH), Epoxide (>O), Schwefelsäureester (-OSO3H), und Endoperoxide (>O2).[6][7][19] Die Fernordnung der hexagonalen Grundstruktur wird durch vereinzelte Punktdefekte (vacancy defects), nicht-hexagonale Strukturmotive (z.B: Stone-Wales-Defekte) und ausgedehnte Löcher gestört, die entweder schon anfänglich im Graphit vorhanden waren oder später durch Überoxidation während der Synthese entstehen (Bildung von CO/CO2).[21][20] An diesen Stellen können zusätzliche Carbonyle (-C=O), Carboxyle (-CO2H) präsent sein und stellen sogenannte in-plane functional groups dar.[4][22][23][19][24] Aufnahmen mit dem Atomkraftmikroskop zeigen, dass die Kohlenstofflagen durch Sauerstoffbindungen verformt werden sowie eine deutlich erhöhte Rauheit besitzen.[25] Diese Defekte erscheinen auch im Ramanspektrum des Graphenoxids. Da die Oxidation in der Regel nur zu einem Funktionalisierungsgrad von ca. ~ 60–70 % führt, befinden sich zwischen den funktionellen Gruppen noch teilweise isolierte bzw. konjugierte Doppelbindungen und aromatische Bereiche.[24][8][26] Je nach gewählter Syntheseroute gibt es einen fließenden Übergang von intaktem Graphen mit oxo-Funktionalitäten über zunehmend löchriges Graphen mit oxo-Funktionalitäten bis hin zu einem Material mit fast komplett zerstörtem Kohlenstoffgitter mit huminsäureartiger Struktur.
Theoretische Berechnungen und Experimente zeigen, dass sich die anfänglich homogen verteilten funktionellen Gruppen eines frisch synthetisierten Graphenoxids durch Alterungsprozesse zu sp² und sp³ dominierten Arealen umlagern.[27] Dieser Prozess wird z. B. durch Säuren beschleunigt.
Graphenoxid als Feststoff kann durch Gefriertrocknung hergestellt werden, besitzt stets jedoch wegen seiner hohen Dichte an polaren funktionellen Gruppen eine geringe Menge an stark gebundenen Wassermolekülen (<10 m%).
Anwendungen

Graphenherstellung
In den 2000er Jahren wurde Graphitoxid als mögliche Vorstufe für die Herstellung von Graphen in großem Maßstab interessant. Aufgrund seiner hydrophilen Eigenschaften löst sich Graphitoxid in Wasser leicht auf, wobei es in mikroskopisch kleine Graphenoxidflocken zerfällt, die meist eine Lage dick sind. Durch chemische Reduktion ist es möglich, eine metastabile Suspension aus Graphenflocken zu erhalten, welche allerdings stark zur Aggregation neigt, dies kann aber durch die vorherige Zugabe von Tensiden weitgehend unterbunden wurden.
Eine partielle bis komplette Reduktion des Graphenoxids kann auf viele unterschiedlich effiziente Weisen erreicht werden. Für eine chemische Reduktion werden hierfür Natriumborhydrid, Glutathion, Ascorbinsäure (Vitamin-C), Hydrazin (24h bei 100 °C) bzw. oder Iodwasserstoff verwendet.[8][29] Weiterhin ist eine Reduktion auch durch kurzzeitige, einige Sekunden dauernde Behandlung mit Plasma aus Wasserstoffgas,[25] einem starken Lichtpuls, wie dem eines Xenon-Blitzes oder UV-Strahlung möglich.[30][31] Die reduzierende Wirkung von UV-Licht kann durch eine Mischung von Aceton und Isopropanol in Wasser (1% bzw. 2%) enorm verstärk werden. Die öfters in der Literatur beschriebene Methode der „Reduktion“ durch die Einwirkung von Natron- bzw. Kalilauge oder Behandlung bei hohen Temperaturen beruht auf einer Disproportionierungsreaktion und der damit einhergehenden partiellen Zerstörung des Kohlenstoffgitters durch CO/CO2-Formation.
Im Vergleich zu den anderen konventionellen Methoden der Graphenherstellung, wie etwa mechanische Exfolierung oder chemische Gasphasenabscheidung (CVD-Prozess), ist die Herstellung im Gramm- bzw. Kilogrammmaßstab ohne weiteres möglich und nicht auf einzelne Kohlenstoff-Filme limitiert.
Graphenoxidpapier
Wie bei der Papierherstellung können Graphenoxidflocken aus einer wässrigen Dispersion geschöpft werden, wobei ein außerordentlich reißfestes Graphenoxidpapier entsteht.
Chemische Eigenschaften
Stabilität
Graphenoxid ist ein wenig temperaturbeständiges Material und zersetzt sich schon bei ~100 °C zu Graphen und CO/CO2 mit einer hohen Anzahl von Lochdefekten.[8][32] Die on-plane funktionellen Gruppen können mittels vieler reduzierend wirkender Stoffe wie z. B. Natriumborhydrid, Glutathion, Ascorbinsäure (Vitamin-C), Hydrazin oder Iodwasserstoff entfernt werden.[8][29] Die Effizienz, mit der dabei die sauerstoffhaltigen funktionellen Gruppen entfernt werden können, unterscheidet sich teilweise immens und ist nicht immer quantitativ.[8] Viele weitere Methoden wie z. B. durch Wasserstoff-Plasma, starke Lichtpulse oder UV-Strahlung sind ebenso bekannt.[25][30][31] Die öfters in der Literatur beschriebene Methode der „Reduktion“ durch die Einwirkung von Natron- bzw. Kalilauge führt ebenso wie eine Behandlung durch hohe Temperaturen (sog. thermally reduced graphene oxide) zu einer partiellen Zerstörung des Kohlenstoffgitters unter Bildung von CO/CO2 während hingegen der andere Teil zu Graphen rearomatisiert. Aus diesem Grund sollte besser von einer thermischen Disproportionierung als einer thermischen Reduktion gesprochen werden.[32][33]
Das Kohlenstoffgerüst von Graphenoxid ist stabil gegenüber Säuren und den kurzzeitigen Kontakt mit Basen bei niedrigen Temperaturen (HCl, H2SO4, NaOH, KOH). Eine kürzere Kontaktzeit mit Basen von wenigen Stunden bei Raumtemperatur oder über mehrere Stunden bei 4 °C führt schon zu einer messbaren Degradierung.[32][33] Die Einwirkungen von verdünnten Säuren und Basen können die Art und Anzahl funktioneller Gruppen verändern. Schwefelsäureester, die oft nach der kalten Aufarbeitung von Graphitoxid während der Synthese vorhanden sind, werden durch Säuren und Basen gespalten. Konzentrierte Säuren mit oxidierbaren Anionen (Bsp.: HCl) führen zu einer partiellen Reduktion, starke Basen hingegen führen zu einer scheinbaren Reduktion (genauer: Disproportionierung von GO zu partiell reduziertem GO und: CO/CO2).[33][34]
Veränderungen des Materials können bei Lagerung unter 10 °C größtenteils unterbunden werden. Dennoch zeigen theoretische Computerberechnungen sowie experimentelle Ergebnisse, dass auch unter diesen Bedingungen funktionelle Gruppen nicht zwangsweise stabil am Kohlenstoffgitter gebunden sind, sondern sich dennoch umlagern können.[35] In der Gegenwart von mehrwertigen Kationen neigt Graphenoxid zur Agglomeration durch Komplexbildung zwischen den einzelnen Graphenoxid-Flocken.
Funktionalisierung
Eine kovalente Funktionalisierung des Kohlenstoffgitters ist möglich über Arylradikale via Diazoniumsalze.[6] Die Modifikation schon während der Synthese eingeführter Gruppen ist möglich über Reaktionen mit Ammoniak/Aminen, Natriumazid[13] oder Isocyanat.[36]
Eine nicht-kovalente Funktionalisierung ist möglich mit Alkylaminen über elektrostatische Anziehung von negativ geladenen Schwefelsäureestern mit den positiv geladenen Alkylammonium-Ionen, sowie mit oberflächenwirksamen Tensiden (Natriumdodecylsulfat, Natriumdodecylbenzolsulfonat, Natriumcholat, …). Partiell reduziertes Graphenoxid kann mit Hilfe gängiger Tenside (SDS, SDBS, Natriumcholat …) gegenüber Agglomeration stabilisiert werden.
Physikalische Eigenschaften
Partikelgröße
Die Größe der einzelnen Graphenoxid-Partikel kann durch Nachbearbeitung mittels Ultraschall, Kugelmühle, Jet-Kavitation etc. gesteuert werden.[37][38] Je nach verwendeter Graphit-Quelle und Delaminierungstechnik sind Partikelgrößen von 50 nm bis unter 20 nm einfach und relativ schnell herstellbar. Da der Teilchenbruch dem Potenzgesetz folgt, brechen kleinere Partikel langsamer als größere.[38] Weiterhin wurde gezeigt, dass die Bruchrate von Grad und Art der Funktionalisierung abhängt: Einerseits bricht Graphenoxid mit einer höheren Dichte an funktionellen Gruppen unter externem Stress leichter als ein Derivat mit weniger funktionellen Gruppen. Enthält das Graphenoxid schwere Schwefelsäure-Ester als funktionelle Gruppen, so ist die Bruchrate im Vergleich zu einem Graphenoxid mit ausschließlich Hydroxyl- und Peroxid-Gruppen bei gleichem Funktionalisierungsgrad erhöht.[39]
Dispergierbarkeit
Je nach Synthese und Art und Menge der funktionellen Gruppen ist Graphenoxid in vielen polaren Lösungsmitteln wie Ethanol, Methanol, DMF, NMP, CHP und Wasser dispergierbar.[6] Teilweise ist eine Aggregation zu Multilagen in reinen organischen Lösungsmitteln sichtbar, kann aber durch die Zugabe von geringen Mengen Wasser verhindert werden. Über nicht-kovalente Funktionalisierung – z. B. mit Alkylaminen – ist auch eine gewisse Dispergierbarkeit in weniger polaren Lösungsmitteln wie THF möglich.[40][41] Graphenoxid wird mit fortschreitender Reduktion – beispielsweise durch Hydrazin oder Natriumborhydrid – zunehmend schlechter dispergierbar in Wasser. Dies kann durch die Zugabe von Tensiden komplett verhindert werden.[42]
Leitfähigkeit
Graphenoxid ist durch seine geringere Menge an sp2-hybridisierten Kohlenstoff-Atomen ein schlechterer Leiter als Graphen, welches ausschließlich sp2-Kohlenstoffatome besitzt. Lochdefekte haben ebenso wie funktionelle Defekte einen großen Einfluss auf die Leitfähigkeit, da hierdurch das Leitfähigkeit vermittelnde π-System gestört wird. Graphitoxid bzw. Graphenoxid – hergestellt nach der Methode von Hummers und Offeman – verhält sich im Allgemeinen wie ein Isolator und besitzt eine differentielle elektrische Leitfähigkeit von 1–5·10−3 S·cm−1. Legt man jedoch eine Vorspannung von 10 V an, ist es hingegen fast ein Halbleiter.[25] Die Leitfähigkeit von Graphen, welches nach der Reduktion von Graphenoxid mit Hydrazin erhalten wird, ist oft mehr als 3 Größenordnungen höher und liegt im Bereich von 10 S·cm−1.[25][30] Die Mobilitäten der Elektron-Loch-Paare betragen 0,5–30 cm2·V−1·s−1 für Elektronen und 2–200 cm2·V−1·s−1 für die Defektelektronen.[25] Diese relativ schlechten Werte im Vergleich zu CVD-Graphen (~ 7.000 cm2·V−1·s−1) und mechanisch efoliertem Graphen (~ 10.000 cm2·V−1·s−1) beruhen darauf, dass das hexagonale Kohlenstoffgerüst durch die Oxidation des Graphits zu Graphitoxid, dessen anschließende Exfolierung und Reduktion zu Graphen mit sehr vielen vacancy defects und ausgedehnten Löchern durchsetzt ist sowie gegebenenfalls nicht vollständig defunktionalisiert wurde.[25][43]
Im Laufe der Zeit wurden nasschemische Darstellungsmethoden von Graphen aus Graphenoxid dahingegen optimiert, sodass diese erheblich größere Werte für die Leitfähigkeit besitzen (~ 250-2.000 cm2/Vs).[17][41][44]
Optische Eigenschaften
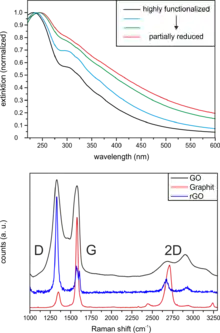
Das Absorptionsspektrum einer Graphenoxid-Suspension zeigt im Wesentlichen drei variable Bereiche, die sich mit unterschiedlichem Funktionalisierungsgrad verändern[45]: Ein Maximum bei ~235 nm (π→π* Übergang), eine Schulter bei ~300 nm (n→π* Übergang) sowie einen auslaufenden Bereich bei höheren Wellenlängen. Die Position des Maximums kann primär zur schnellen Bestimmung des Grades der Funktionalisierung (sp³-Defekte) herangezogen werden. Eine bathochrome Verschiebung des Maximums sowie das Verschwinden der Schulter und das Ansteigen der Extinktion sind ein Indiz für eine Reduktion des Ausgangsmaterials.
Mittels Raman-Spektroskopie können durch unterschiedliche Techniken functional und vacancy defects sichtbar gemacht werden.[46][47] Hierbei werden die sogenannte D (Defect), G (Graphite) und 2D-Bande in Verhältnis gesetzt und ausgewertet. Üblicherweise werden Proben des Materials auf SiO2/Si-Oberflächen abgeschieden. Anschließend werden diese mit einem monochromatischen Laserstrahl beschossen und die Stokes bzw. Anti-Stokes Streuung gemessen. Perfektes Graphen besitzt idealerweise keine D-Bande, eine dünne G-Bande sowie eine 2D-Bande mit ~ 1.5 facher Intensität. Mit zunehmender Anzahl an strukturellen Defekten nimmt die Intensität der D-Bande bis zu einem maximalen ID/IG-Verhältnis zu und danach mit fortschreitenden Funktionalisierung wieder ab. Der Maximalwert hängt hierbei von der Anregungswellenlänge des verwendeten Lasers ab.[47] Ebenso nimmt mit zunehmender Defektdichte das Verhältnis I2D/IG stark ab. Zusätzlich gilt pauschal, dass die Halbwertsbreite jeder Bande mit zunehmender Anzahl an Defekten zunimmt.[47] Graphenoxid mit einem hohen Funktionalisierungsgrad (30%-70%) besitzt ein ID/IG-Verhältnis von ~1.0-1.2 (Laser: 532 nm), welches mit abnehmender Anzahl von funktionellen Gruppen (partielle Reduktion) bis zu einem Maximalwert ansteigt.
Einzelnachweise
- B. C. Brodie: Note sur un nouveau procédé pour la purification et la désagrégation du Graphite. Hrsg.: Ann. Chim. Phys. Band 45, 1855, S. 351–353.
- Georges Charpy: Lur Sar Formation de L'oxyde Graphitique et la Définition du Graphite. Hrsg.: Comptes rendus hebdomadaires des séances de l'Académie des sciences. Nr. 5, 1909, S. 920–923.
- Ulrich Hofmann, Alfred Frenzel: Quellung von Graphit und die Bildung von Graphitsäure. In: Berichte der deutschen chemischen Gesellschaft (A and B Series). Band 63, Nr. 5, 7. Mai 1930, S. 1248–1262, doi:10.1002/cber.19300630543.
- William S. Hummers, Richard E. Offeman: Preparation of Graphitic Oxide. In: Journal of the American Chemical Society. Band 80, Nr. 6, März 1958, S. 1339–1339, doi:10.1021/ja01539a017.
- Hanns Peter Boehm, Werner Scholz: Vergleich der Darstellungsverfahren für Graphitoxyd. Band 691. Justus Liebigs Annalen der Chemie, 1965, S. 1–8.
- Daniel R. Dreyer, Sungjin Park, Christopher W. Bielawski, Rodney S. Ruoff: The chemistry of graphene oxide. In: Chemical Society Reviews. Band 39, Nr. 1, 14. Dezember 2009, S. 228–240, doi:10.1039/b917103g.
- Siegfried Eigler, Andreas Hirsch: Chemistry with Graphene and Graphene Oxide—Challenges for Synthetic Chemists. In: Angewandte Chemie International Edition. Band 53, Nr. 30, 21. Juli 2014, S. 7720–7738, doi:10.1002/anie.201402780.
- Siegfried Eigler, Stefan Grimm, Michael Enzelberger-Heim, Paul Müller, Andreas Hirsch: Graphene oxide: efficiency of reducing agents. In: Chemical Communications. Band 49, Nr. 67, 26. Juli 2013, doi:10.1039/c3cc43612h.
- B. C. Brodie: On the Atomic Weight of Graphite. Hrsg.: Proceedings Proceedings of the Royal Society of London. 1859, S. 11–12.
- Ulrich Hofmann Ernst König: Untersuchungen über Graphitoxyd. Hrsg.: Zeitschrift für Anorganische und Allgemeine Chemie. Band 234, Nr. 4, 1937, S. 311–336.
- L. Staudenmaier: Verfahren zur Darstellung der Graphitsäure. In: Berichte der deutschen chemischen Gesellschaft. Band 31, Nr. 2, 1898, S. 1481–1487, doi:10.1002/cber.18980310237.
- Patrick Feicht, Renée Siegel, Herbert Thurn, Jens W. Neubauer, Maximilian Seuss: Systematic evaluation of different types of graphene oxide in respect to variations in their in-plane modulus. In: Carbon. Band 114, April 2017, S. 700–705, doi:10.1016/j.carbon.2016.12.065.
- Siegfried Eigler, Yichen Hu, Yoshitaka Ishii, Andreas Hirsch: Controlled functionalization of graphene oxide with sodium azide. In: Nanoscale. Band 5, Nr. 24, 22. November 2013, doi:10.1039/c3nr04332k, PMID 24162364, PMC 3880578 (freier Volltext).
- Ayrat M. Dimiev, James M. Tour: Mechanism of Graphene Oxide Formation. In: ACS Nano. Band 8, Nr. 3, 25. März 2014, ISSN 1936-0851, S. 3060–3068, doi:10.1021/nn500606a.
- W. Rüdorff, U. Hofmann: Über Graphitsalze. In: Zeitschrift für anorganische und allgemeine Chemie. Band 238, Nr. 1, 24. Juni 1938, S. 1–50, doi:10.1002/zaac.19382380102.
- Steffen Seiler, Christian E. Halbig, Fabian Grote, Philipp Rietsch, Felix Börrnert: Effect of friction on oxidative graphite intercalation and high-quality graphene formation. In: Nature Communications. Band 9, Nr. 1, Dezember 2018, ISSN 2041-1723, doi:10.1038/s41467-018-03211-1, PMID 29483555, PMC 5826935 (freier Volltext).
- Siegfried Eigler: Graphite sulphate – a precursor to graphene. In: Chem. Commun. Band 51, Nr. 15, 5. Februar 2015, S. 3162–3165, doi:10.1039/c4cc09381j.
- Siegfried Eigler, Michael Enzelberger-Heim, Stefan Grimm, Philipp Hofmann, Wolfgang Kroener: Wet Chemical Synthesis of Graphene. In: Advanced Materials. Band 25, Nr. 26, 12. Juli 2013, S. 3583–3587, doi:10.1002/adma.201300155.
- Anton Lerf, Heyong He, Michael Forster, Jacek Klinowski: Structure of Graphite Oxide Revisited‖. In: The Journal of Physical Chemistry B. Band 102, Nr. 23, Juni 1998, S. 4477–4482, doi:10.1021/jp9731821.
- Patrick Feicht, Siegfried Eigler: Defects in Graphene Oxide as Structural Motifs. In: ChemNanoMat. Band 4, Nr. 3, März 2018, S. 244–252, doi:10.1002/cnma.201700357.
- Florian Banhart, Jani Kotakoski, Arkady V. Krasheninnikov: Structural Defects in Graphene. In: ACS Nano. Band 5, Nr. 1, 25. Januar 2011, ISSN 1936-0851, S. 26–41, doi:10.1021/nn102598m.
- Ulrich Hofmann, Alfred Frenzel, E. Csalán: Die Konstitution der Graphitsäure und ihre Reaktionen. In: Justus Liebigs Annalen der Chemie. Band 510, Nr. 1, 1934, S. 1–41, doi:10.1002/jlac.19345100102.
- M Mermoux, Y Chabre, A Rousseau: FTIR and 13C NMR study of graphite oxide. In: Carbon. Band 29, Nr. 3, 1991, S. 469–474, doi:10.1016/0008-6223(91)90216-6.
- Siegfried Eigler, Andreas Hirsch: Chemistry with Graphene and Graphene Oxide—Challenges for Synthetic Chemists. In: Angewandte Chemie International Edition. Band 53, Nr. 30, 21. Juli 2014, S. 7720–7738, doi:10.1002/anie.201402780.
- C. Gomez-Navarro et al.: Electronic Transport Properties of Individual Chemically Reduced Graphene Oxide Sheets. In: Nano Letters. 7, Nr. 11, 2007, S. 3499, doi:10.1021/nl072090c.
- Patrick Feicht, Daniel A. Kunz, Anton Lerf, Josef Breu: Facile and scalable one-step production of organically modified graphene oxide by a two-phase extraction. In: Carbon. Band 80, Dezember 2014, S. 229–234, doi:10.1016/j.carbon.2014.08.061.
- H. Pieper, C. E. Halbig, L. Kovbasyuk, M. R. Filipovic, S. Eigler: Oxo-Functionalized Graphene as a Cell Membrane Carrier of Nucleic Acid Probes Controlled by Aging. In: Chemistry - A European Journal. Band 22, Nr. 43, 17. Oktober 2016, S. 15389–15395, doi:10.1002/chem.201603063.
- A. V. Talyzin et al.: Nanocarbons by High-Temperature Decomposition of Graphite Oxide at Various Pressures. In: J. Phys. Chem. C. 113, Nr. 26, 2008, S. 11279–11284, doi:10.1021/jp9016272.
- S. Stankovich et al.: Stable aqueous dispersions of graphitic nanoplatelets via the reduction of exfoliated graphite oxide in the presence of poly(sodium 4-styrenesulfonate). In: J. Material Chemistry. 16, 2006, S. 155, doi:10.1039/b512799h.
- Laura J. Cote, Rodolfo Cruz-Silva, Jiaxing Huang: Flash Reduction and Patterning of Graphite Oxide and Its Polymer Composite. In: Journal of the American Chemical Society. 131, 2009, S. 11027–11032, doi:10.1021/ja902348k.
- Roman Flyunt, Wolfgang Knolle, Axel Kahnt, Christian E. Halbig, Andriy Lotnyk: High quality reduced graphene oxide flakes by fast kinetically controlled and clean indirect UV-induced radical reduction. In: Nanoscale. Band 8, Nr. 14, 2016, ISSN 2040-3364, S. 7572–7579, doi:10.1039/C6NR00156D.
- Siegfried Eigler, Stefan Grimm, Ferdinand Hof, Andreas Hirsch: Graphene oxide: a stable carbon framework for functionalization. In: Journal of Materials Chemistry A. Band 1, Nr. 38, 10. September 2013, doi:10.1039/c3ta12975f.
- Ayrat M. Dimiev, Lawrence B. Alemany, James M. Tour: Graphene Oxide. Origin of Acidity, Its Instability in Water, and a New Dynamic Structural Model. In: ACS Nano. Band 7, Nr. 1, 22. Januar 2013, S. 576–588, doi:10.1021/nn3047378.
- Christian E. Halbig, Philipp Rietsch, Siegfried Eigler: Towards the Synthesis of Graphene Azide from Graphene Oxide. In: Molecules. Band 20, Nr. 12, 26. November 2015, S. 21050–21057, doi:10.3390/molecules201219747 (mdpi.com [abgerufen am 12. Dezember 2016]).
- H. Pieper, C. E. Halbig, L. Kovbasyuk, M. R. Filipovic, S. Eigler: Oxo-Functionalized Graphene as a Cell Membrane Carrier of Nucleic Acid Probes Controlled by Aging. In: Chemistry – A European Journal. Band 22, Nr. 43, 17. Oktober 2016, S. 15389–15395, doi:10.1002/chem.201603063.
- Sasha Stankovich, Richard D. Piner, SonBinh T. Nguyen, Rodney S. Ruoff: Synthesis and exfoliation of isocyanate-treated graphene oxide nanoplatelets. In: Carbon. Band 44, Nr. 15, 1. Dezember 2006, S. 3342–3347, doi:10.1016/j.carbon.2006.06.004.
- Johannes Walter, Thomas J. Nacken, Cornelia Damm, Thaseem Thajudeen, Siegfried Eigler: Determination of the Lateral Dimension of Graphene Oxide Nanosheets Using Analytical Ultracentrifugation. In: Small. Band 11, Nr. 7, 1. Februar 2015, S. 814–825, doi:10.1002/smll.201401940.
- Christian E. Halbig, Thomas J. Nacken, Johannes Walter, Cornelia Damm, Siegfried Eigler: Quantitative investigation of the fragmentation process and defect density evolution of oxo-functionalized graphene due to ultrasonication and milling. In: Carbon. Band 96, 1. Januar 2016, S. 897–903, doi:10.1016/j.carbon.2015.10.021.
- Thomas J. Nacken, Christian E. Halbig, Simon E. Wawra, Cornelia Damm, Stefan Romeis: Structural factors controlling size reduction of graphene oxide in liquid processing. In: Carbon. Band 125, Dezember 2017, S. 360–369, doi:10.1016/j.carbon.2017.09.066.
- Patrick Feicht, Daniel A. Kunz, Anton Lerf, Josef Breu: Facile and scalable one-step production of organically modified graphene oxide by a two-phase extraction. In: Carbon. Band 80, Dezember 2014, S. 229–234, doi:10.1016/j.carbon.2014.08.061.
- Zhenxing Wang, Siegfried Eigler, Yoshitaka Ishii, Yichen Hu, Christian Papp: A facile approach to synthesize an oxo-functionalized graphene/polymer composite for low-voltage operating memory devices. In: Journal of Materials Chemistry C. Band 3, Nr. 33, 2015, ISSN 2050-7526, S. 8595–8604, doi:10.1039/C5TC01861G.
- Christian E. Halbig, Oliver Martin, Frank Hauke, Siegfried Eigler, Andreas Hirsch: Oxo-Functionalized Graphene: A Versatile Precursor for Alkylated Graphene Sheets by Reductive Functionalization. In: Chemistry - A European Journal. Band 24, Nr. 50, 6. September 2018, S. 13348–13354, doi:10.1002/chem.201802500.
- Morgan A. Brown, Michael S. Crosser, Matthew R. Leyden, Yabing Qi, Ethan D. Minot: Measurement of high carrier mobility in graphene in an aqueous electrolyte environment. In: Applied Physics Letters. Band 109, Nr. 9, 29. August 2016, ISSN 0003-6951, S. 093104, doi:10.1063/1.4962141.
- Benjamin Butz, Christian Dolle, Christian E. Halbig, Erdmann Spiecker, Siegfried Eigler: Highly Intact and Pure Oxo-Functionalized Graphene: Synthesis and Electron-Beam-Induced Reduction. In: Angewandte Chemie International Edition. Band 55, Nr. 51, 19. Dezember 2016, S. 15771–15774, doi:10.1002/anie.201608377.
- Goki Eda, Yun-Yue Lin, Cecilia Mattevi, Hisato Yamaguchi, Hsin-An Chen: Blue Photoluminescence from Chemically Derived Graphene Oxide. In: Advanced Materials. Band 22, Nr. 4, 26. Januar 2010, S. 505–509, doi:10.1002/adma.200901996.
- Siegfried Eigler, Ferdinand Hof, Michael Enzelberger-Heim, Stefan Grimm, Paul Müller: Statistical Raman Microscopy and Atomic Force Microscopy on Heterogeneous Graphene Obtained after Reduction of Graphene Oxide. In: The Journal of Physical Chemistry C. Band 118, Nr. 14, 10. April 2014, S. 7698–7704, doi:10.1021/jp500580g.
- L. G. Cançado, A. Jorio, E. H. Martins Ferreira, F. Stavale, C. A. Achete: Quantifying Defects in Graphene via Raman Spectroscopy at Different Excitation Energies. In: Nano Letters. Band 11, Nr. 8, 10. August 2011, S. 3190–3196, doi:10.1021/nl201432g.