Graphitoxid
Graphitoxid, früher auch Graphitsäure, ist eine nichtstöchiometrische Verbindung der chemischen Elemente Kohlenstoff, Sauerstoff und Wasserstoff; sie kann aus Graphit unter Einwirkung starker Oxidantien gewonnen werden. In seiner maximal oxidierten Form bildet Graphitoxid einen gelben Feststoff; das Verhältnis von Kohlenstoff zu Sauerstoff reicht von 2,1:1 bis 2,9:1. Graphitoxid hat eine mit Graphit vergleichbare Schichtenstruktur, wenn auch die Abstände zwischen den Molekülebenen größer und unregelmäßiger sind.[2]
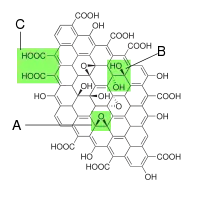
In basischen Lösungen zerfällt Graphitoxid in Flocken mit monomolekularer Schichtdicke, die als Graphenoxid bezeichnet werden (in Anlehnung an Graphen, die einlagige Form des Graphits).[3] Aus Graphenoxid kann ein hochfester papierähnlicher Werkstoff, Graphenoxidpapier, hergestellt werden, der in jüngster Zeit als mögliches Zwischenprodukt der Graphenherstellung interessant geworden ist. Allerdings (Stand 2010) weist auf diesem Weg hergestelltes Graphen noch zahlreiche chemische und strukturelle Unregelmäßigkeiten auf.
Geschichte und Darstellung
Die erste Darstellung von Graphitoxid gelang 1859 dem britischen Chemiker Benjamin Collins Brodie jr., der Graphit mit einer Mischung aus Kaliumchlorat und rauchender Salpetersäure behandelte.[4] Schneller und ungefährlicher, bei höherer Ausbeute, ist das 1957 von William S. Hummers and Richard E. Offeman beschriebene Verfahren; sie verwendeten eine Mischung aus Schwefelsäure H2SO4, Natriumnitrat NaNO3, und Kaliumpermanganat KMnO4. Diese Methode ist bis heute (Stand 2013) im Einsatz.[2]
In jüngster Zeit wurde eine Mischung aus H2SO4 und KMnO4 benutzt, um Kohlenstoffnanoröhren in Längsrichtung aufzuschneiden, dabei entstehen mikroskopisch kleine, flache Graphenbänder mit einer Breite von wenigen Atomen, die an den Enden eine Kappe aus Sauerstoffatomen (=O) oder Hydroxygruppen tragen (–OH).[5]
Struktur
Struktur und Eigenschaften des Graphitoxids werden durch die verwendete Synthesemethode und den erzielten Oxidationsgrad bestimmt.[6] Die Schichtstruktur des eingesetzten Graphits bleibt typischerweise erhalten, aber die Lagen sind unregelmäßig hinsichtlich ihrer Planarität und weisen einen bis zu zweimal größerem Abstand (ungefähr 0,7 nm) als Graphit auf. Anders als der historisch etablierte Name Graphitoxid andeutet, handelt es sich im strengen Sinn nicht um ein Oxid. Neben Epoxid- wurden experimentell noch folgende funktionelle Gruppen gefunden: Carbonyl- (=CO), Hydroxy- (-OH), Schwefelsäureester (-OSO3H) sowie Endoperoxide (-O2-).[7][8][9][10][11]
Die exakte Struktur ist aufgrund des recht variablen Abstands der Lagen sowie der insgesamt geringen Ordnung im Detail noch nicht verstanden. Der Abstand der Graphenoxidlagen beträgt 1,1 ± 0,2 nm.[8][9] Aufnahmen mit dem Rastertunnelmikroskop lassen Regionen erkennen, in denen Sauerstoffatome in einem rechtwinkligen Muster mit einer Gitterkonstante von 0,27 nm × 0,41 nm angeordnet sind.[9][12] Die Kanten jeder Lage werden von Carboxygruppen- und Carbonylgruppen begrenzt.[8] Mittels Röntgen-Photoelektronenspektroskopie lässt sich zeigen, dass Kohlenstoffatome auch in Ringen ohne Sauerstoff (284,8 eV) vorhanden sind (vergleiche 286,2 eV für C–O, 287,8 eV für C=O und 289,0 eV für O–C=O).
Graphitoxid nimmt sehr leicht Wasser auf, wodurch der Abstand zwischen den einzelnen Ebenen erheblich zunimmt (bis zu 1,2 nm im gesättigten Zustand). Bei höheren Drücken wird zusätzlich Wasser in den Raum zwischen den einzelnen Lagen eingebaut. Die Graphitoxidmasse speichert Feuchtigkeit aus der Umgebungsluft in Proportion zur Luftfeuchtigkeit. Eine vollständige Trocknung erscheint schwierig, da ein Erhitzen auf 60–80 °C zur teilweisen Zersetzung des Materials führt.
Durch rasches Erhitzen auf 280–300 °C zersetzt sich Graphitoxid (englisch Exfoliation), wobei ein fein verteiltes, amorphes Kohlenstoffpulver, vergleichbar mit Aktivkohle, entsteht.
Anwendungen

Graphenherstellung
In den 2000er Jahren wurde Graphitoxid als mögliche Vorstufe für die Herstellung von Graphen in großem Maßstab interessant. Graphitoxid ist ein Isolator;[14] mit einer differentiellen elektrischen Leitfähigkeit von 5·10−3 S·cm−1; bei einer Vorspannung von 10 V ist es fast ein Halbleiter.[14]
Siehe auch
Weblinks
- Video zur Spaltung von Graphitoxid auf youtube.com
Einzelnachweise
- Heyong Hea, Jacek Klinowskia, Michael Forsterb, Anton Lerf: A new structural model for graphite oxide. In: Chemical Physics Letters. Volume 287, Issues 1–2, 1998, S. 53–56, doi:10.1016/S0009-2614(98)00144-4.
- William S. Hummers Jr., Richard E. Offeman: Preparation of Graphitic Oxide. In: J. American Chemical Society. 80, Nr. 6, 1958, S. 1339–1339, doi:10.1021/ja01539a017.
- Daniel R. Dreyer, Sungjin Park, Christopher W. Bielawski, Rodney S. Ruoff: The chemistry of graphene oxide. In: Chemical Society Reviews. 39, 2010, S. 228–240, doi:10.1039/b917103g.
- Benjamin C. Brodie: On the Atomic Weight of Graphite. In: Proceedings of the Royal Society of London. 10, 1859, S. 249, JSTOR 108699.
- Dmitry V. Kosynkin, Amanda L. Higginbotham, Alexander Sinitskii, Jay R. Lomeda, Ayrat Dimiev, B. Katherine Price, James M. Tour: Longitudinal unzipping of carbon nanotubes to form graphene nanoribbons. In: Nature. 458, 16. April 2009, S. 872–876, doi:10.1038/nature07872.
- H.P. Boehm, W. Scholz: Untersuchungen am Graphitoxyd, IV. Vergleich der Darstellungsverfahren für Graphitoxyd. In: Justus Liebigs Annalen der Chemie. 691, 1966, S. 1–8. doi:10.1002/jlac.19666910102.
- A. Lerf et al.: Structure of graphite oxide revisited. In: Journal Of Physical Chemistry B. 102, Nr. 23, 1998, S. 4477–4482, doi:10.1021/jp9731821.
- H. C. Schniepp et al.: Functionalized Single Graphene Sheets Derived from Splitting Graphite Oxide. In: American J. of Physical Chemistry, Serie B. 110, 2009, S. 8535, doi:10.1021/jp060936f.
- D. Pandey, R. Reifenberger, R. Piner: Scanning probe microscopy study of exfoliated oxidized graphene sheets. In: Surface Science. 602, Nr. 9, 2008, S. 1607–1613, doi:10.1016/j.susc.2008.02.025.
- Daniel R. Dreyer, Sungjin Park, Christopher W. Bielawski, Rodney S. Ruoff: The chemistry of graphene oxide. In: Chemical Society Reviews. Band 39, Nr. 1, 14. Dezember 2009, S. 228–240, doi:10.1039/b917103g.
- Siegfried Eigler, Christoph Dotzer, Ferdinand Hof, Walter Bauer, Andreas Hirsch: Sulfur Species in Graphene Oxide. In: Chemistry - A European Journal. Band 19, Nr. 29, 15. Juli 2013, S. 9490–9496, doi:10.1002/chem.201300387 (wiley.com [abgerufen am 14. Mai 2019]).
- K. A. Mkhoyan et al.: Atomic and Electronic Structure of Graphene-Oxide. Nano Letters. 9, Nr. 3, 2009, S. 1058–1063, doi:10.1021/nl8034256.
- A. V. Talyzin et al.: Nanocarbons by High-Temperature Decomposition of Graphite Oxide at Various Pressures. In: J. Phys. Chem. C. 113, Nr. 26, 2008, S. 11279–11284, doi:10.1021/jp9016272.
- C. Gomez-Navarro et al.: Electronic Transport Properties of Individual Chemically Reduced Graphene Oxide Sheets. In: Nano Letters. 7, Nr. 11, 2007, S. 3499, doi:10.1021/nl072090c.