Salzbrücke
Eine Salzbrücke, auch Ionenbrücke, Elektrolytbrücke oder Stromschlüssel genannt, dient als ionenleitende Verbindung zwischen Elektrolyt-Lösungen. Sie ermöglicht den freien Fluss von Ionen zwischen verbundenen Systemen. Im Falle eines aus zwei Halbzellen bestehenden galvanischen Elementes verhindert die Salzbrücke den Aufbau von Ladung in den Halbzellen, welche den Stromfluss ansonsten frühzeitig zum Erliegen bringen würde. Generell werden Salzbrücken oder ihre Alternativen verwendet, wenn mehrere Systeme zwar miteinander verbunden sein sollen, die freie Diffusion der Teilchen zwischen den Systemen jedoch minimiert werden soll. Der Elektrolyt in Salzbrücken ist eine konzentrierte Salzlösung. Bei der Auswahl des Salzes ist zu beachten, dass Anion und Kation möglichst ähnliche Überführungszahlen besitzen. Dies ist vor allem bei Kaliumchlorid der Fall, aber auch Kaliumnitrat und Ammoniumnitrat werden verwendet. Außerdem darf es nicht mit den zu verbindenden Elektrolyten reagieren.
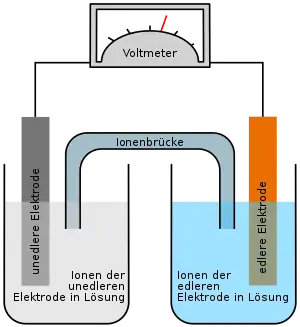
Die wichtigste Anwendung von Salzbrücken liegt in der Analytik, genauer der Elektroanalytik,[1] z. B. der Anwendung elektrochemischer Sensoren: Für ein genaues Analysenergebnis ist es wichtig, dass die Verbindung zur Bezugselektrode Potentialmessungen nicht verfälscht. Daneben dienen Salzbrücken auch zur Verbindung der Halbzellen von galvanischen Elementen. In beiden Fällen gilt: Wenn über die Strombrücke nur eine Spannung gemessen werden soll, darf die Strombrücke relativ hochohmig sein, d. h. die Brücke darf auch lang und/oder schmal sein. Wenn auch ein Strom fließen soll, z. B. wenn man ein galvanisches Element als leistungsfähige Stromquelle nutzen möchte, sollte auf einen kleinen Widerstand geachtet werden. Die Brücke sollte dann kürzer sein und einen ausreichenden Durchmesser haben.
Als Salzbrücke dienen oft U-förmige Glasrohre (U-Rohre), die mit der konzentrierten Salzlösung gefüllt werden und deren Schenkel in die zu verbindenden Elektrolytlösungen eintauchen. Auch Kunststoff- oder Gummischläuche werden verwendet. Die Lösung kann verdickt werden (beispielsweise mit Agar), wodurch verhindert wird, dass die Salzlösung sich mit den Kontakflüssigkeiten vermischt. Die Leitfähigkeit dieser Art von Salzbrücken nimmt mit steigender Konzentration der Salzlösung zu, bis ein Maximum erreicht wird, ab dem die Leitfähigkeit wieder absinkt. Außerdem nimmt die Leitfähigkeit mit größer werdendem Durchmesser des U-Rohres zu. Luftblasen in der Salzbrücke verringern die Leitfähigkeit und sind daher zu vermeiden.
Wenn nur kleine Ströme auftreten, z. B. bei Potentialmessungen mit hochohmigen elektronischen Spannungsmessgeräten, können auch Filterpapierstreifen verwendet werden, die mit der konzentrierten Salzlösung getränkt sind und deren Enden in die zu verbindenden Elektrolytlösungen eintauchen. Die Leitfähigkeit dieser Art von Salzbrücken hängt auch von den Eigenschaften des Filterpapiers ab.
Historisches
Zur Verbindung von Bezugselektroden wurden Salzbrücken verwendet, ohne diese so zu bezeichnen. So stellte Wilhelm Ostwald nach seinem 1893 veröffentlichtem Buch die Verbindung einer Kalomelelektrode zu den betrachteten Halbzellen her, indem er einen mit Kaliumchlorid gefüllten Gummischlauch verwendete.[2] Dieser hatte einen Quetschhahn und konnte so leicht verschlossen werden.[2]
Die Entdeckung, dass sich in Salzbrücken Kaliumchloridlösungen besser als die Lösungen anderer Salze eignen, wurde vom US-Amerikaner Olin Freeman Tower (1872–1945) gemacht, als er Student bei Ostwald in Leipzig war.[3] Er veröffentlichte seine Ergebnisse 1896.[4] In der zweiten Auflage von Ostwalds Buch „Hand- und Hülfsbuch zur Ausführung physiko-chemischer Messungen“ werden verschiedene Elektrolytbrücken vorgestellt, wobei diejenigen aus Glas mit dem Begriff „Heberrohr“ bezeichnet werden.[5] Daneben erwähnt Ostwald Dochte aus Baumwolle oder Asbest.[5] Niels Bjerrum berichtete 1905 über seine Messungen an Salzbrücken mit Kaliumchloridlösung.[6]
Literatur
- Daniel C. Harris: Lehrbuch der Quantitativen Analyse. 8. Auflage. Springer-Verlag, 2014, ISBN 978-3-642-37788-4, Kapitel 13: Grundlagen der Elektrochemie, S. 318 (eingeschränkte Vorschau in der Google-Buchsuche).
Einzelnachweise
- Takashi Kakiuchi: Salt bridge in electroanalytical chemistry: past, present, and future. In: Journal of Solid State Electrochemistry. Band 15, Nr. 7-8. Springer, Juli 2011, ISSN 1432-8488, S. 1661–1671, doi:10.1007/s10008-011-1373-0 (springer.com).
- Wilhelm Ostwald: Hand- und Hilfsbuch zur Ausführung physiko-chemischer Messungen. 1. Auflage. Wilhelm Engelmann, Leipzig 1893, Fünfzehntes Kapitel: Elektrische Messungen. Normal-Elektroden., S. 258 (online im Internet Archive [abgerufen am 2. Oktober 2019]): „Die zweite […] Röhre trägt einen Gummischlauch von etwa 10 cm Länge, […] alles ist mit der Chlorkaliumlösung angefüllt.“
- Fritz Scholz, Takashi Kakiuchi: Salt Bridges and Diaphragms. In: Handbook of Reference Electrodes. Springer Berlin Heidelberg, Berlin, Heidelberg 2013, ISBN 978-3-642-36187-6, S. 49–76, doi:10.1007/978-3-642-36188-3_4 (springer.com [abgerufen am 2. Oktober 2019]).
- Olin Freeman Tower: Ueber Potentialdifferenzen an den Berührungsflächen verdünnter Lösungen. In: Zeitschrift für Physikalische Chemie. 20U, Nr. 1. De Gruyter, Mai 1896, ISSN 2196-7156, S. 198–206, doi:10.1515/zpch-1896-2014 (degruyter.com).
- Wilhelm Ostwald, Robert Thomas Dietrich Luther: Hand- und Hülfsbuch zur Ausführung physiko-chemischer Messungen. 2. Auflage. Wilhelm Engelmann, Leipzig 1902, Sechzehntes Kapitel: Elektromotorische Kraft. Metallelektroden., S. 377–378 (online bei der Universität Innsbruck [abgerufen am 2. Oktober 2019]): „(entfettete) Baumwoll- und Asbestdochte […] Heberröhren […]mit elektrolythaltiger Agar- oder Gelatinegallerte;“
- Niels Bjerrum: Über die Elimination des Diffusionspotentials zwischen zwei verdünnten wässerigen Lösungen durch Einschalten einer konzentrierten Chlorkaliumlösung. In: Zeitschrift für Physikalische Chemie. 53U, Nr. 1, 1. Januar 1905, ISSN 2196-7156, S. 428–440, doi:10.1515/zpch-1905-5325 (degruyter.com).