Konzentrationselement
Ein Konzentrationselement (auch Konzentrationszelle) ist eine galvanische Zelle, in der aufgrund chemischer Reaktionen ähnlich einer Batterie eine nutzbare elektrische Spannung entsteht.
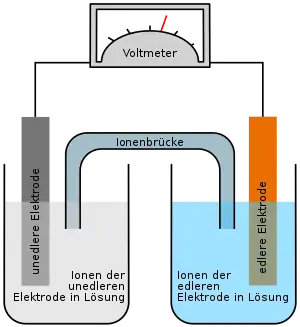
Das Besondere an einer solchen Konzentrationskette ist, dass sie aus zwei Halbzellen besteht, die gleichartig aufgebaut sind und sich nur in der Elektrolytkonzentration unterscheiden. Die beiden Elektroden bestehen also aus dem gleichen Material und die Elektrolyte enthalten die gleichen Ionensorten. Die chemische Reaktion in der einen Halbzelle ist daher bei Stromfluss die Umkehrung der Reaktion in der anderen. Da die beiden Halbzellen jedoch die Tendenz haben, die Konzentrationen anzugleichen, entsteht dennoch eine messbare Spannung.
Die Konzentrationskette dient heute vor allem zu Demonstrationszwecken, da man mit ihr die Konzentrationsabhängigkeit des Elektrodenpotentials bzw. des chemischen Potentials qualitativ zeigen und quantitativ überprüfen kann. Dadurch kann man sie nutzen, um die Nernst-Gleichung herzuleiten.
Beispiel: Metall-Auflösung und -Abscheidung
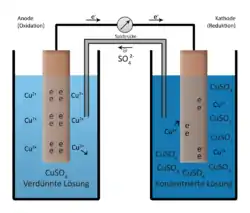
Häufig werden Konzentrationszellen benutzt, bei denen Metallelektroden in Lösungen eines Salzes desselben Metalls tauchen, z. B. Zinkelektroden in Zinksalzlösungen, Eisenelektroden in Eisenchloridlösungen oder Kupferelektroden in Kupfersulfatlösung. Dann wird in der einen Zelle das Metall in Lösung gehen, in der anderen wird es wieder abgeschieden. Da sich beim Stromfluss die Konzentrationen angleichen, wird sich das Metall in der Halbzelle mit dem verdünnten Elektrolyten lösen und in derjenigen mit dem konzentrierteren abscheiden.
Schließt man die Zelle kurz, so dass Strom fließen kann und die Reaktionen stattfinden können, wird Folgendes ablaufen:
Auf der Seite mit der verdünnteren Lösung wird das Metall der Elektrode unter Abgabe von Elektronen zu Metallionen oxidiert; es geht als Ionen in die verdünnte Lösung über und erhöht die Konzentration in der Halbzelle. Aufgrund der Elektronenabgabe ist dies die negative Elektrode, der Minuspol. Da hier eine Oxidation erfolgt, ist es definitionsgemäß die Anode. Wie bei den Batterien ist also hier der Minuspol die Anode. Die freiwerdenden Elektronen wandern über einen elektrischen Leiter zur anderen Elektrode. Dort reduzieren sie die in der konzentrierten Lösung vorhandenen Metallionen zu elementarem Metall, das sich an der Elektrode anlagert. Aufgrund der Reduktion ist dies die Kathode. Da die Metallionen eine positive Ladung mitbringen, wenn sie sich anlagern, ist dies der Pluspol. Die Konzentration dieser Halbzelle sinkt. Der Konzentrationsausgleich zwischen den beiden Halbzellen erfolgt über eine Salzbrücke. Diese Salzbrücke ist so konzipiert, dass sie nach Möglichkeit weder Elektronen, noch die positiv geladenen Metallionen (Kationen) hindurchlässt. Die einzigen Teilchen, die hindurchgelassen werden, sind die negativ geladenen Anionen, die in der Salzlösung vorliegen. Die Konzentrationen beider Halbzellen nähern sich somit einander an, bis kein Konzentrationsunterschied mehr besteht. Auf diese Weise wird der Stromkreis geschlossen.
Berechnung der Spannung
Zur Berechnung der Potentialdifferenz der galvanischen Zelle kann man die Nernst-Gleichung benutzen. Da das Standardpotential (siehe Elektrochemische Spannungsreihe) der beiden Halbzellen gleich ist, lässt sich die Nernst-Gleichung zum folgenden Term vereinfachen:
- , mit .
Bezeichnungen:
- : Anzahl der Übergangselektronen pro Oxidation/Reduktion
- : Elektrolytkonzentration in der Akzeptorhalbzelle (Kathode)
- : Elektrolytkonzentration in der Donatorhalbzelle (Anode)
- : Universelle Gaskonstante | Universelle oder molare Gaskonstante, = 8,31447 J mol−1 K−1 = 8,31447 C V mol−1 K−1
- : absolute Temperatur (= Temperatur in Kelvin)
- : Faraday-Konstante, = 96485,34 C mol−1 = 96485,34 J V−1 mol−1
Bei Temperaturen zwischen 21,7 °C und 26,7 °C ergibt sich daraus die Gleichung
- , mit ;
weitere Zahlenwerte sind im Artikel Elektrodensteilheit angegeben.
Im Falle = sind die Halbzellen gleich. Es gibt keinen Potentialunterschied zwischen den Elektroden und die zwischen den Halbzellen messbare Spannung ist 0 V.
Weblinks
- Konzentrationselement (Memento vom 18. Juli 2013 im Internet Archive) (PDF-Datei; 97 kB)
- Versuch Chemie (Memento vom 11. Februar 2013 im Webarchiv archive.today)
- Konzentrationsabhängigkeit (PDF-Datei; 192 kB)