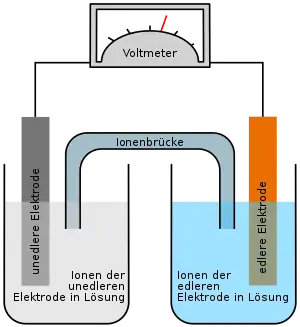
Halbzelle
Die Halbzelle (Halbelement) ist Bestandteil des galvanischen Elements. Sie setzt sich zusammen aus einer Elektrode (z. B. Metallstab, Metallblech, Graphit), die in einen Elektrolyten (oft die zu einer Metallelektrode entsprechende Metallsalzlösung) taucht. Eine Zinkhalbzelle erhält man, indem man eine Zinkelektrode in eine Säure, Lauge oder Salzlösung (zum Beispiel Zinksulfat-Lösung) taucht. Die Halbzellen eines galvanischen Elements werden unterschieden nach dem jeweiligen Metall (vgl. Zinkhalbzelle, Kupferhalbzelle etc.) sowie ihrer Funktion, die sie bei der Zellreaktion einnehmen (Donatorhalbzelle, Akzeptorhalbzelle).
Von der Halbzelle zum galvanischen Element
Aus zwei Halbzellen lässt sich ein galvanisches Element aufbauen, indem man die beiden Halbzellen über einen Ionenleiter miteinander verbindet, z. B. mit einer Elektrolytbrücke oder durch Eintauchen in einen gemeinsamen Elektrolyten. Um das galvanische Element zu nutzen muss man die Elektroden der beiden Halbzellen auch noch mit einem Elektronenleiter elektrisch leitend verbinden – beispielsweise mit Metalldraht. So wird der Stromkreis außerhalb der Zellen durch den Elektronenleiter, und zwischen ihnen durch die ionenleitende Verbindung zwischen den Metallsalzlösungen geschlossen. Das Daniell-Element als Beispiel eines galvanischen Elementes setzt sich aus einer Zinkhalbzelle und einer Kupferhalbzelle zusammen, diese können z. B. durch ein ionenleitenden lösungsgesättigten porösen Steinguttiegel verbunden sein.
Chemische Vorgänge in Halbzellen
Sofort nach dem Eintauchen der Metallelektroden in die entsprechende Metallsalzlösung spielen sich an der Metalloberfläche Vorgänge ab, die ein Aufladen der Metallelektroden zur Folge haben. Unedle Metalle haben die Tendenz, in wässriger Lösung zu oxidieren; in diesem Fall lösen sich Metallatome aus dem Metallgitter der Elektrode und gehen als Metallionen in Lösung. Die bei einer Oxidation der Metallatome freigesetzten Elektronen bleiben im Metall an dessen Oberfläche gebunden. Auf diese Weise lädt sich die Metalloberfläche negativ auf. Da die gebildeten Metallionen stets positiv geladen sind, werden sie infolge dieser negativen Aufladung an die Metalloberfläche gebunden. Dadurch entsteht innerhalb der Phasengrenzfläche zwischen Metalloberfläche und Metallsalzlösung eine sogenannte elektrische Doppelschicht. In ihr gleichen sich negative (Elektronen) und positive Ladungen (Metallionen) aus, da die Zahl z der pro Metallion gebildeten Elektronen der Ladungszahl der entsprechenden Metallionen entspricht. Somit werden zum Beispiel in einer Zinkhalbzelle pro gebildetem zweifach positiven Zinkion auch zwei Elektronen frei, so dass sich negative und positive Ladungen stets ausgleichen.
Innerhalb der elektrischen Doppelschicht stellt sich nach kurzer Zeit in jeder Halbzelle ein dynamisches Gleichgewicht zwischen den entsprechenden Redoxpaaren Metallelemente/Metallionen ein. So stellt sich in der Zinkhalbzelle des Daniell-Elements nach kurzer Zeit an der Metalloberfläche das Gleichgewicht
ein. In der Kupferhalbzelle des Daniell-Elements befindet sich eine Kupfersulfatlösung, die bei einer neuen Zelle in der Regel gesättigt ist. Auch hier stellt sich nach kurzer Zeit an der Metalloberfläche das Gleichgewicht
ein.
Bildung einer elektrischen Spannung zwischen zwei Halbzellen
Das Entscheidende bezüglich der negativen Aufladung aber ist, dass die oben genannten Gleichgewichte im Gleichgewichtszustand eine unterschiedliche Gleichgewichtslage besitzen. Diese Gleichgewichtslage hängt von der Größe der Lösungstension des entsprechenden Metalls ab, die je nach Metall ganz unterschiedlich groß ist. Dies wiederum hängt mit der Stellung der Metalle in der Redoxreihe der Metalle zusammen.
Der Grund dafür ist, dass die Lösungstension eines Metalls dem Bestreben der Metallatome, als Reduktionsmittel zu wirken, entspricht. Denn die Lösungstension entspricht der Oxidation der Metallatome, d. h. der Elektronenabgabe, die somit frei werden und andere Teilchen reduzieren (siehe Reduktion) können. Dieses Reduktionsvermögen von Metallen ist in der Redoxreihe der Metalle dokumentiert.
Das Metall Zink zum Beispiel ist unbeständiger und daher unedler. Es hat eine größere Tendenz, in Redoxreaktionen als Reduktionsmittel zu wirken (d. h. selbst zu oxidieren). Seine Lösungstension in wässriger Lösung ist daher größer als die edlerer Metalle wie Zinn, Kupfer oder Silber. Daher liegt das Gleichgewicht in der Zinkhalbzelle
weiter rechts als das Gleichgewicht in der Kupferhalbzelle des Daniell-Elements:
Betrachtet man die Gleichgewichte genauer, so erkennt man, dass sich entsprechend der Gleichgewichtslage auch unterschiedliche Mengen an Überschusselektronen (Elektronenvorräte, Elektronendrücke) in den Metallelektroden angesammelt werden. Die beiden Halbzellen unterschieden sich somit nun als Orte eines höheren und eines niedrigeren Elektronendrucks. Da das entsprechende oben genannte Gleichgewicht an der Zinkelektrode infolge der höheren Lösungstension des Zinks weiter rechts liegt, lädt sich die Zinkelektrode stärker negativ auf als die Kupferelektrode, weil Kupfer als beständigeres und edleres Metall eine geringere Lösungstension hat (vgl. die Stellung der Metalle in der Redoxreihe der Metalle). Somit ist die Zinkelektrode der Ort des höheren Elektronendrucks, die Kupferelektrode der Ort des niedrigeren Elektronendrucks.
Auf diese Weise bildet sich zwischen den beiden Halbzellen des Daniell-Elements eine elektrische Spannung. Häufig spricht man dabei auch von einer Potentialdifferenz. Der Grund dafür ist, dass die Gleichgewichtslage des allgemeinen Gleichgewichts
mit der Höhe des Elektronendrucks (s. o.) auch das elektrochemische Potential eines Metalls (Me) bestimmt. Je weiter dieses Gleichgewicht auf der rechten Seite liegt, desto höher ist der Elektronendruck und desto negativer das elektrochemische Potential des Metalls. Die Größe der elektrochemischen Potentiale von Metallen unter Normbedingungen ist quantitativ in der Spannungsreihe der Metalle dokumentiert. Je negativer das Standardelektrodenpotential eines Metalls in der Spannungsreihe der Metalle ist, desto größer ist also der Elektronendruck, den dieses entsprechende Metall in einer Halbzelle eines galvanischen Elements entwickelt und desto größer ist (qualitativ gesehen) sein Reduktionsvermögen. Daher entspricht die Stellung der Metalle in der Redoxreihe der Metalle auch ihrer Stellung in der Spannungsreihe der Metalle. Kombiniert man in einem galvanischen Element entsprechend zwei Halbzellen von Metallen mit unterschiedlichem elektrochemischen Potential, so entsteht eine Potentialdifferenz, die dem Begriff der elektrischen Spannung entspricht. Diese Potentialdifferenz entspricht somit der oben beschriebenen Elektronendruckdifferenz zwischen den beiden Halbzellen.
Einflussfaktoren auf die Spannungsgröße zwischen zwei Halbzellen
Auf die oben beschriebene Weise entwickelt jedes galvanische Element eine elektrische Spannung. Die Größe der elektrischen Spannung hängt von zwei wesentlichen Faktoren ab, die aus der Ursache für die Entstehung der Spannung, den unterschiedlichen Gleichgewichtslagen, resultieren:
- Die Größe der Spannung hängt vom stofflichen System ab. Das bedeutet, dass die Spannung von der Halbzellenwahl bestimmt wird. Somit entwickelt das Daniell-Element (d. h. das galvanische Element aus einer Zink- und einer Kupferhalbzelle) mit U = 1,11 V (unter Normbedingungen) eine andere Spannung als das galvanische Element aus einer Magnesium- und einer Silberhalbzelle mit U = 3,06 V (unter Normbedingungen). Die Ursache dafür ist, dass je nach Halbzellenwahl die Unterschiede in den Lösungstensionen der Metalle verschieden groß sind.
- Die Größe der Spannung hängt von der Konzentration der Metallsalzlösungen ab. Somit kann man selbst in einem galvanischen Element aus zwei gleichen Halbzellen eine Spannung entwickeln, wenn die Elektrolytlösungen unterschiedliche Konzentrationen haben. Solche Anordnungen nennt man dann Konzentrationszellen bzw. Konzentrationsketten. Die Ursache für diesen Faktor ist, dass sich an den Elektroden wie beschrieben Gleichgewichte einstellen und diese nach dem Prinzip von LeChâtelier (siehe Chemisches Gleichgewicht) durch Konzentrationsänderungen hinsichtlich ihrer Gleichgewichtslage gestört werden.
Stromfluss zwischen zwei Halbzellen und Zellreaktion
Solange der Widerstand zwischen den beiden leitend miteinander verbundenen Elektroden hoch ist, bleibt ein Stromfluss als Folge der Entladung der Spannung aus und somit die entstandene Spannung konstant. Ermöglicht man aber einen Stromfluss, indem man den Widerstand zwischen den beiden leitend miteinander verbundenen Elektroden senkt (bspw. statt eines Voltmeters einen kleinen Motor anschließt), so kommt es zum Abbau der Spannung und somit einem Elektronenaustausch zwischen den beiden Halbzellen. Infolge der Spannung wirkt dann zwischen den beiden Elektroden eine elektromotorische Kraft. Sie treibt die Elektronen vom Ort des höheren Elektronendrucks zum Ort des niedrigeren Elektronendrucks, so dass sich die Elektronendruckdifferenz, die Spannung, allmählich ausgleicht. Somit werden Elektronen aus der Halbzelle des höheren Elektronendrucks an die Halbzelle des niedrigeren Elektronendrucks abgegeben. Daher bezeichnet man die Halbzelle des höheren Elektronendrucks, d. h. mit dem Metall, das das negativere Elektrodenpotential besitzt, als Donatorhalbzelle, die andere Halbzelle (als „elektronenempfangende Zelle“) als Akzeptorhalbzelle.
Infolge der Gleichgewichtsstörungen an den Elektroden durch den Stromfluss findet die Zellreaktion des galvanischen Elements statt. Somit strömen im Daniell-Element Elektronen von der Zinkhalbzelle zur Kupferhalbzelle. Die Folge dessen ist, dass an der Zinkelektrode die Größe der negativen Ladung zurückgeht, so dass der oben beschriebene Ausgleich zwischen negativen (Elektronen) und positiven Ladungen (Metallionen) ins Ungleichgewicht gerät. Da die negative Ladung an der Zinkelektrode zurückgeht, können sich somit nun Zinkionen aus der elektrischen Doppelschicht lösen und in die Lösung diffundieren. Nach dem Prinzip von LeChâtelier verschiebt sich das Gleichgewicht
entsprechend nach rechts, d. h. in der Zinkhalbzelle findet verstärkt die Oxidation statt. In der Kupferhalbzelle hingegen sorgen die zuströmenden Elektronen für eine verstärkte Reduktion von Kupferionen aus der Kupfersalzlösung. An der Kupferelektrode findet somit verstärkt die Reduktion von Kupferionen zu Kupfer statt, so dass sich das Gleichgewicht
weiter nach links verschiebt. Somit findet nun in der Zinkhalbzelle verstärkt die Oxidation, in der Kupferhalbzelle verstärkt die Reduktion statt. Die Zinkelektrode bezeichnet man damit als Anode (Elektrode, an der die Oxidation stattfindet) und die Kupferelektrode als Kathode (Elektrode, an der die Reduktion stattfindet). Die ablaufenden Vorgänge lassen sich somit in der Zellreaktion zusammenfassen, die nach
verläuft. Bei dieser Zellreaktion ist die Zinkhalbzelle die Donator-, die Kupferhalbzelle die Akzeptorhalbzelle.
Halbzellenprozesse während der Zellreaktion und Reaktionsende
Während der Zellreaktion wird nicht nur einfach infolge des Stromes die Potentialdifferenz abgebaut, sondern vor allem auch wegen der in den Halbzellen ablaufenden Prozesse. Im Daniell-Element findet während der Zellreaktion in der Zinkhalbzelle (Donatorhalbzelle) verstärkt die Oxidation statt, d. h. es werden vermehrt Zinkionen gebildet. Infolgedessen nimmt während der Zellreaktion die Masse der Zinkelektrode ab und die Konzentration der Zinkionen in der Zinkhalbzelle zu. Dies hat eine Rückwirkung auf das Gleichgewicht
an der Zinkelektrode zur Folge. Denn aufgrund der während der Zellreaktion zunehmenden Zinkionenkonzentration verschiebt sich dieses Gleichgewicht nach dem Prinzip von Le Châtelier zunehmend in Richtung der Reduktion, d. h. die zunächst schwache Reduktion gewinnt an Stärke und holt die zunächst starke Oxidation in der Zinkhalbzelle allmählich ein. Im Laufe der Zellreaktion stellt sich an der Zinkelektrode also ein neues Gleichgewicht ein.
In der Kupferhalbzelle findet ein umgekehrter Vorgang statt. Infolge der dort starken Reduktion von Kupferionen zu Kupfer nimmt die Masse der Kupferelektrode während der Zellreaktion zu und die Konzentration der Kupferionen in der Kupfersalzlösung ab. Auch in der Kupferhalbzelle hat dies eine Rückwirkung auf das Gleichgewicht
zur Folge. Nach dem Prinzip von Le Châtelier verschiebt sich das Gleichgewicht dabei infolge der abnehmenden Kupferionenkonzentration zunehmend in Richtung der Oxidation, d. h. die zunächst schwache Oxidation holt die zunächst starke Reduktion in der Kupferhalbzelle allmählich ein. Im Laufe der Zellreaktion stellt sich somit auch in der Kupferhalbzelle ein neues Gleichgewicht ein.
Die Zellreaktion, d. h. die durch den Elektronenaustausch zwischen den beiden Halbzellen bewirkten Reaktionen an den Elektroden, kommt schließlich zum Erliegen, wenn sich an den beiden Elektroden wie beschrieben die neuen Gleichgewichte eingestellt haben, d. h. an beiden Elektroden die Oxidations- und die Reduktionsstärke identisch sind. Denn dann existiert keine Spannung mehr zwischen den Elektroden, so dass auch kein Elektronenübergang mehr stattfindet und die Zellreaktion als Redoxreaktion (Elektronenaustauschreaktion) somit beendet ist. Da auch die Zellreaktion umkehrbar ist, befindet sich dann auch die gesamte Zellreaktion im Gleichgewichtszustand.