Donatorhalbzelle
Die Donatorhalbzelle ist diejenige Halbzelle in einem Galvanischen Element, in der die Oxidation (Elektronen-Abgabe) der reduzierten Form eines Redoxpaares (häufig ein Metall) zur oxidierten Form stattfindet.
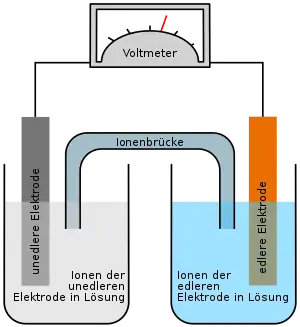
Sie wird mit der Akzeptorhalbzelle mittels einer Salzbrücke (Ionenbrücke) verbunden. Die Folge ist, dass sich die Metallatome der Elektrode der Halbzelle zu positiv geladenen Ionen umwandeln und die Elektrode sich allmählich auflöst. In der Chemie werden positiv geladene Ionen Kationen, negativ geladene Anionen genannt, denn sie wandern in einem elektrischen Feld als Ionenstrom zur Kathode („Minuspol“ des Feldes) bzw. zur Anode („Pluspol“ des Feldes). In einem Lösungsmittel bildet sich um das Ion eine Solvathülle aus.
Die Stärke eines Oxidationsmittels kann durch Messung der Potentialdifferenz zu einer Referenzelektrode gemessen werden. Die Halbzelle in einem Galvanischen Element mit dem negativeren Normalpotential ist immer die Donatorhalbzelle. Der Name Donator kommt daher, dass bei der Oxidation Elektronen an die anderen Halbzelle (Akzeptorhalbzelle) abgegeben werden.
In einem Daniell-Element ist die Halbzelle mit der Zinkelektrode die Donatorhalbzelle, Zink wird zu Zinkionen oxidiert. In einer Wasserstoff-Brennstoffzelle ist Wasserstoff der Donator, er wird unter Elektronenabgabe zu Wasserstoffionen oxidiert
Siehe auch
Literatur
- Michael Wächter: Tabellenbuch der Chemie: Daten zur Analytik, Laborpraxis und Theorie, John Wiley & Sons, 2012, ISBN 978-3-527-32960-1.