Nickel-Metallhydrid-Akkumulator
Ein Nickel-Metallhydrid-Akkumulator (NiMH) ist ein Akkumulator mit einer positiven Elektrode aus Nickel(II)-hydroxid und einer negativen Elektrode aus einem Metallhydrid. Die technischen Grundlagen wurden von Stanford Ovshinsky und Masahiko Oshitani ab 1962 bis 1982 zur marktreifen Zelle entwickelt.

NiMH-Akkumulatoren sind vielfach in den üblichen Bauformen von Standardbatterien verbreitet und liefern pro Zelle eine Nennspannung von 1,2 V bei einer typischen Entladeschlussspannung von 1,0 V. Sie können damit zumeist als wiederaufladbare Alternative die gängigen Alkalibatterien in haushaltsüblichen Geräten ersetzen. Vorteile gegenüber den mittlerweile nicht mehr frei verkäuflichen Nickel-Cadmium-Akkumulatoren (NiCd) bestehen im Fehlen des giftigen Cadmiums und einer höheren Energiedichte.
Seit 2006 sind NiMH-Akkumulatoren mit geringer Selbstentladung auf dem Markt, die sich gegenüber herkömmlichen NiMH-Akkus durch eine erheblich reduzierte Selbstentladung auszeichnen.
Eigenschaften
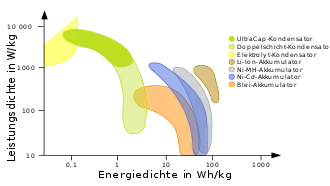
Die Energiedichte einer NiMH-Zelle beträgt etwa 80 Wh/kg und ist damit fast so groß wie die einer Alkali-Mangan-Zelle und mehr als doppelt so groß wie die eines NiCd-Akkus. Für die Baugröße Mignon (AA) sind Kapazitäten von 800 bis 2650 mAh erhältlich. Für Ersatzzwecke zum Austausch von NiCd-Zellen gibt es auch Sonderausführungen mit nur 600 bis 900 mAh, die mit alten Ladeschaltungen besser verträglich sein sollen. NiMH-Akkus der Größe Micro (AAA) gibt es mit bis zu 1.100 mAh, Baby- mit bis zu 6.000 mAh und Monozellen mit bis zu 12.000 mAh Kapazität. Als typische Entladeschlussspannung von NiMH-Zellen sind 1,0 V anzusehen.[1]
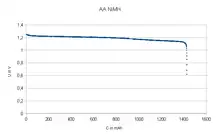
Die niederohmigen NiMH-Akkus (geringerer Innenwiderstand gegenüber Batterien) können im Unterschied zu Zink-Kohle-Zellen ihre gespeicherte Energie innerhalb kurzer Zeit mit nahezu gleichbleibender Spannung abgeben.
NiMH-Akkumulatoren haben wie NiCd-Akkus eine nominale Spannung von 1,2 V je Zelle. Dennoch werden sie in vielen Anwendungen als Ersatz für Zink-Kohle- und Alkaline-Batterien verwendet, welche 1,5 V Nennspannung je Zelle aufweisen. Bei manchen Anwendungen kann die niedrigere Nennspannung aber von Nachteil sein. Z. B. leuchten ungeregelte Taschenlampen, die für 1,5-V-Batterien ausgelegt sind, mit 1,2-V-Akkus durch die niedrigere Spannung in der Regel deutlich weniger hell. Unter hoher Last kann der Akku mit dem Vorteil seines geringeren Innenwiderstandes eine höhere Spannung halten.
Einschränkungen
NiMH-Akkus reagieren empfindlich auf Überladung, Überhitzung, falsche Polung, Tiefentladung (Stromentnahme bis zur nahezu vollständigen Erschöpfung der Ladekapazität) oder Tiefentladung mit Umpolung, wie sie z. B. bei in Reihe geschalteten Zellen auftreten kann. Die dabei mögliche Abnahme der elektrischen Lademenge (Kapazität) lässt sich auch durch besondere Maßnahmen wie vollständiges Entladen (bis auf 1 V unter Last) oder gar wiederholtes Laden und Entladen nicht wieder rückgängig machen (das hat sogar den negativen Effekt, dass sich die Lebensdauer aufgrund der beschränkten Zahl möglicher Ladezyklen verringert). Zum Erreichen der Solllebensdauer von typischerweise 500 Ladezyklen (entsprechend zehn Jahren bei wöchentlicher Ladung) ist ein intelligentes Ladegerät unentbehrlich.
NiMH-Akkus sind nicht für den Betrieb bei Temperaturen unterhalb von 0 °C geeignet.[2] Bereits in der Nähe des Gefrierpunktes weisen sie durch die Verringerung der Beweglichkeit der Elektronen einen deutlich höheren Innenwiderstand auf, durch den die Spannung unter Last einbricht und nur geringe Ströme (Leistungen) entnehmbar sind. Unterhalb von −10 °C bricht die Leistungsfähigkeit ein. Bei Temperaturen über 50 °C sind sie nicht mehr ladbar.[3]
Anstelle des besonders bei älteren NiCd-Akkus relevanten Memory-Effektes kommt es bei NiMH-Akkus nach häufigen Teilentladungen zum Batterieträgheitseffekt, einem Abfall der erzielbaren Entladespannung, der aber weitgehend reversibel ist.[4]
Vergleich mit anderen Akkumulatoren-Typen
Bei kleinen Bauformen beherrschte zunächst der Nickel-Cadmium-Akkumulator (NiCd-Akku) den Markt, der als erster die nur einmal nutzbare Batterie ersetzen konnte. Nachdem dieser von NiMH-Akku verdrängt wurde, hat der leistungsfähigere und inzwischen preislich akzeptable Lithium-Ionen-Akkumulator die Marktführerrolle übernommen. NiMH-Akkus mit der schwierigeren Ladeschlusserkennung spielen bei Neuprodukten abnehmend nur noch bei geringem Energiebedarf im Bereich von Micro (AAA) und Mignon (AA) Zellen eine Rolle. Das früher verbreitete Baby (C) und Mono (D) Format ist fast vollständig vom Markt verschwunden.
NiMH-Akkus bieten im Vergleich zu NiCd-Akkus mit bei gleicher Spannung ungefähr die doppelte Energiedichte. Sie haben diese, die in bestimmten Anwendungen und Bauformen wie den Mignonzellen durch ein EU-weites Handelsverbot belegt sind, weitgehend verdrängt. NiMH-Akkus kommen ohne das giftige Schwermetall Cadmium aus.
NiMH-Akkus haben aber auch Nachteile gegenüber NiCd-Akkus: geringere Zyklenfestigkeit, geringerer maximaler Lade- und Entladestrom, kleinerer Temperaturbereich und geringere Robustheit gegen minderwertige Ladeverfahren oder Tiefentladung sowie schwierigere Ladeschlusserkennung. Jedoch sind sie robuster als Lithium-ionen-Kraftzellen.[5]
Funktionsweise
Aufbau

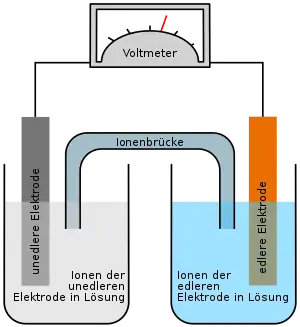
Das Bild rechts zeigt die Komponenten eines geöffneten NiMH-Akkus. Die Lochfolie (links) dient als Träger für die Metall-Legierung bzw. das Metallhydrid-Pulver, das die negative Elektrode bildet. Hierfür wird zum Beispiel eine Legierung mit der Verhältnisformel La0.8Nd0.2Ni2.5Co2.4Si0.1 verwendet. Der Separator (Mitte) nimmt den Elektrolyten, eine 20-prozentige Kalilauge mit einem pH-Wert von 14, auf und verhindert den unmittelbaren Kontakt zur positiven Elektrode. Diese besteht aus einem Blech aus Nickel(II)-hydroxid und schwarzem Nickeloxidhydrat (Nickel(III)-hydroxid) (rechts).
Die Folien werden mit außenliegender negativer Elektrode aufgewickelt und mit einem Metallzylinder ummantelt (aufgesägt, unten links). Das Gehäuse ist elektrisch leitend mit der negativen Elektrode verbunden und bildet den Minuspol des Akkus. Eine elektrische Zuleitung vom Nickeloxid-Blech (rechts, blauisolierter Metallstreifen) führt zum Kopf der Zelle und bildet den Pluspol.
Elektrochemie
Beim Ladevorgang werden am Minuspol H+-Ionen (Protonen) zu Wasserstoff reduziert, der reversibel von der Metalllegierung gebunden und als Metallhydrid gespeichert wird. Am Pluspol wird beim Ladevorgang Nickel der Oxidationsstufe +II (in Form von Nickel(II)-hydroxid) zu Nickel der Oxidationsstufe III (zu Nickel(III)-oxidhydrat NiO(OH)) oxidiert.
Beim Entladen wird der im Metallhydrid (M+H−) gebundene Wasserstoff zu einem Proton (H+) oxidiert und es entsteht ein Metall der Oxidationsstufe 0 (M0). Die entstehenden Protonen reagieren mit den OH−-Ionen (Hydroxidionen) der Kalilauge zu Wasser. Das Redoxpotential bei pH 14 beträgt ca. −0,83 V(1). Durch die ebenfalls bei der Reaktion entstehenden freien Elektronen wird dieser Pol zum Minuspol. Am anderen Pol wird Nickel der Oxidationsstufe +III (NiO(OH) oder Ni2O3·H2O) zu Nickel der Oxidationsstufe +II (Ni(OH)2) reduziert. Dabei werden freie Elektronen gebunden, so dass dieser Pol zum Plus-Pol wird. Die Redoxspannung beträgt ca. +0,49 V(2). Die Gesamtspannung der Summen-Reaktion beträgt 1,32 V(3).
(1) Oxidation: | −0,83 V | ||
(2) Reduktion: | +0,49 V | ||
(3) Redoxreaktion: | Summe: 1,32 V | Leerlaufspannung |
Damit gegen Ende der Entladung nicht das Metall statt des Wasserstoffs oxidiert, verbaut man eine negative Elektrode, die viel größer ist als die positive Elektrode. Letztere bestimmt damit die Kapazität des Akkumulators: Das Nickel(III)-oxidhydroxid an der kleineren positiven Elektrode ist erschöpft, bevor der Wasserstoff an der größeren negativen Elektrode vollständig aufgebraucht ist.
Aufladung

Selbstentladung
Herkömmliche NiMH-Akkus haben eine Selbstentladerate von fünf bis zehn Prozent am ersten Tag und stabilisieren sich dann bei einem halben bis einem Prozent pro Tag bei Raumtemperatur. Diese hohe Selbstentladung verhindert den Einsatz solcher Akkus in Geräten, bei denen eine Batterielebensdauer von mehreren Monaten oder Jahren gewünscht ist, wie zum Beispiel Uhren, Fernbedienungen oder gar sicherheitsrelevanten Geräten wie Feuermeldern oder Taschenlampen für den Notfall. Die Umgebungstemperatur hat einen starken Einfluss auf die Höhe der Entladerate, niedrigere Umgebungstemperaturen haben eine niedrigere Selbstentladungsrate, höhere Umgebungstemperaturen eine höhere Selbstentladungsrate zur Folge. Ebenso hat die Kapazität einen Einfluss auf die Selbstentladungsrate: Höchstkapazitative Zellen (> 2700 mAh für Zellen in AA-Größe) haben die höchste Selbstentladungsrate.
2006 wurde ein neuer Typ von NiMH-Akkus vorgestellt, NiMH mit geringer Selbstentladung, die durch Verwendung neuer Separatoren eine deutlich niedrigere Selbstentladungsrate vorweisen. Sie können vorgeladen verkauft werden und müssen nicht wie herkömmliche Akkus vor dem ersten Gebrauch geladen werden. Ihre Selbstentladungsrate soll bei Raumtemperaturlagerung nur 15 Prozent pro Jahr betragen. Sie können in herkömmlichen Ladegeräten geladen werden und haben ähnliche Ladezyklen (500 bis 1000) wie bisherige NiMH-Akkus. Sanyo war als erster mit solchen Akkus (Eneloop) auf dem Markt, bald darauf folgten andere Hersteller.
Batterieträgheitseffekt
Der Batterieträgheitseffekt (oder englisch lazy battery effect) bezeichnet eine vor allem NiMH-Akkus betreffende Leistungsminderung und einen geringen Abfall um 50 mV bis 100 mV bei der erzielbaren Entladespannung. Diese fällt nicht wie beim vor allem NiCd-Akkus betreffenden Memory-Effekt weit vor Erreichen der Nennlademenge plötzlich stark ab, sondern bleibt über den gesamten Entladevorgang etwas geringer als bei einer gesunden Zelle. Die entnehmbare Ladungsmenge (abgegebene Stromstärke mal Zeit) ist jedoch fast gleich.
Dazu führen verschiedene Ursachen wie Dauerladung oder Lagerung, weniger eine ständige Teilentladung. Beim praktischen Einsatz macht der Effekt nur dann Probleme, wenn von Geräten höhere Mindestspannungen benötigt werden oder wenn z. B. Digitalkameras recht empfindlich auf eine zu geringe Spannung reagieren, den Akku zu früh als entladen annehmen und sich dann abschalten, um vermeintlich Tiefentladung zu vermeiden.
Eine schwedische Forschergruppe entdeckte 2018, dass sie den Alterungsprozess von NiMH-Akkus durch Zugabe von Sauerstoff fast vollständig verhindern können, der das verlorene Elektrodengleichgewicht wiederherstellt und den verlorenen Elektrolyten ersetzt. Dies ist bei diesen Akkus problemlos, da sich alle Zellen den gleichen Gasraum teilen.[6]
Der Batterieträgheitseffekt ist reversibel: Er kann durch etwa fünf vollständige Lade- und Entladezyklen mit einem geeigneten Ladegerät wieder beseitigt werden. (Zunächst Voll-Entladung mit Strom von ca. 1/10 C/h bis auf ca. 0,9 V unter Last. Für die anschließende Voll-Ladung werden höhere Ladeströme von 0,5 bis 1 C/h empfohlen.)
Verwendung


Vergleichbar mit NiCd-Akkus kommen NiMH-Akkumulatoren überall dort zur Anwendung, wo hoher Energiebedarf besteht und hohe Batteriekosten vermieden werden sollen, und als Ersatz für nicht-wiederaufladbare Alkaline-Batterien und Nickel-Zink-Batterien.
- Kleinleuchten, LED-Leuchten
- Spielzeuge
- Fernsteuerungen
- Audio-, Foto- und Videogeräte
- Elektrische Zahnbürsten und Rasierapparate
- Schnurlose DECT-Telefone
- Softairwaffen
- GPS-Geräte
- Elektrowerkzeuge
- Hybrid-Fahrzeuge (insbesondere Modelle der Automarke Toyota)
- Taschenlampen
NiMH-Akkus sind auch gebräuchlich als Energiespeicher in Notbeleuchtungsanlagen.
Als Traktionsbatterie wurden NiMH-Akkus erstmals beim General Motors EV1 eingesetzt. Später verkaufte GM die Mehrheitsanteile von Ovonics, die die Produktion der NiMH-Akkus mittels Patenten kontrollierten, an den Ölkonzern Texaco. Dadurch wurden Weiterentwicklung und Verwendung stark eingeschränkt. Der Toyota Prius verwendet zum Beispiel 228 in Reihe geschaltete 6,5-Ah-NiMH-Akkus mit einer Gesamtspannung über 200 V zur Versorgung eines 60-kW-Elektromotors. Die patentrechtlich erlaubte Obergrenze für die Zellenkapazität ist 10 Ah. Es sind verschiedene Rechtsstreitigkeiten, unter anderem mit Matsushita, anhängig. Alternativ lassen sich große Akkus von der zu Ovonics gehörenden Konzerntochter Cobasys erwerben.
Literatur
- Chapter 22: Michael Fetcenko, John Koch: Nickel-Metal Hydride Batteries. In: Thomas B. Reddy (Hrsg.): Linden's Handbook of Batteries, 4. Auflage, McGraw-Hill, New York 2011, ISBN 978-0-07-162421-3
- Claus Daniel, Jürgen O. Besenhard: Handbook of Battery Materials. Wiley-VCH, Weinheim 2011, ISBN 3-527-32695-2.
- Kapitel 2.4. Der Nickel-Metallhydrid-Akkumulator. In: P. Birke, M. Schiemann: Akkumulatoren: Vergangenheit, Gegenwart und Zukunft elektrochemischer Energiespeicher, H. Utz Verlag, München 2013, ISBN 978-3-8316-0958-1, S. 153–164
- Dell, Rand: Understanding Batteries, Royal Society of Chemistry, 2001, ISBN 0-85404-605-4, S. 138–141
Einzelnachweise
- Uday A. Bakshi, Varsha U. Bakshi: Basic Electrical Engineering. 2., überarb. Aufl. Technical Publications Pune, Pune 2009, ISBN 978-81-8431-694-0, Kap. 1, S. 67.
- slowflyer.ch: Temperaturabhängigkeit von LSD-NNiMH-Akkus. (Memento vom 3. September 2014 im Internet Archive) Abgerufen am 30. August 2014.
- Die Elektrifizierung des Antriebsstrangs: Basiswissen. Springer-Verlag, 2014, ISBN 978-3-658-04644-6, S. 58 (books.google.de).
- Valentin Crastan: Hybridisierung und Regelung eines mobilen Direktmethanol-Brennstoffzellen-Systems. Forschungszentrum Jülich, 2010, ISBN 978-3-89336-642-2, S. 28 (books.google.de).
- Maximizing Battery Life & Cycle Life for AA and AAA batteries. In: michaelbluejay.com.
- Yang Shen: Development of metal hydride surface structures for high power NiMH batteries : Also extended cycle-life and lead to more effective recycling methods. Stockholm 2018 (diva-portal.org [PDF; abgerufen am 6. Januar 2019]).