Silbersulfat
Silbersulfat ist das Silbersalz der Schwefelsäure, in welchem Silber in der Oxidationsstufe +1 vorliegt. Das Salz wird unter anderem bei der Reinigung von Wasser (keimtötend) eingesetzt.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
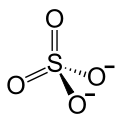 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Silbersulfat | |||||||||||||||
| Andere Namen | ||||||||||||||||
| Summenformel | Ag2SO4 | |||||||||||||||
| Kurzbeschreibung |
weiße rhombische Kristalle[2] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 311,79 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte |
5,45 g·cm−3 [3] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
Zersetzung bei 1085 °C[3] | |||||||||||||||
| Löslichkeit |
schlecht in Wasser (8 g·l−1 bei 25 °C)[3] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||
| ΔHf0 |
−715,9 kJ/mol[4] | |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Silbersulfat entsteht durch Auflösen von Silber in heißer konzentrierter Schwefelsäure:[2]
oder durch Metathese von Silbernitrat in einer wässrigen Lösung eines Alkalimetallsulfates:[2]
- M = Alkalimetallion
hierbei fällt aus,
Einzelnachweise
- Eintrag zu SILVER SULFATE in der CosIng-Datenbank der EU-Kommission, abgerufen am 18. September 2021.
- Eintrag zu Silbersulfat. In: Römpp Online. Georg Thieme Verlag, abgerufen am 28. Dezember 2014.
- Eintrag zu Silbersulfat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 10. Januar 2017. (JavaScript erforderlich)
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-4.
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. The authors of the article are listed here. Additional terms may apply for the media files, click on images to show image meta data.

