Furin
Furin ist eine Endoprotease der Proprotein-Convertase-Familie (PC), das die proteolytische Reifung von Präkursor-Proteinen im eukaryotischen Proteinsekretionsweg katalysiert. Es ist ein überall im Organismus von Wirbeltieren und vielen Wirbellosen exprimiertes Typ-I-Transmembranprotein.[1][2] Zu den Substraten gehören Wachstumsfaktoren, Rezeptoren, extrazelluläre Matrixproteine und auch andere Protease-Systeme, die bestimmte Krankheiten kontrollieren. Neben der Aktivierung von Krankheitserregern spielt es außerdem eine essentielle Rolle in der Embryogenese und der Homöostase.
| Furin | ||
|---|---|---|
| ||
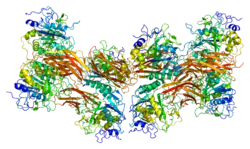
| Bändermodell von Furin, nach PDB 1P8J | ||
| Andere Namen |
| |
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 794 aa, 86.678 Da | |
| Sekundär- bis Quartärstruktur | Homotetramer | |
| Kofaktor | Ca2+ | |
| Isoformen | 1 (+ 4 potentielle [computergestützt]) | |
| Bezeichner | ||
| Gen-Name | FURIN | |
| Externe IDs | ||
| Enzymklassifikation | ||
| EC, Kategorie | 3.4.21.75, Hydrolase | |
| MEROPS | S08.071 | |
| Reaktionsart | Hydrolyse | |
| Substrat | Präkursor-Protein | |
| Produkte | reifes Protein + Peptid | |
| Vorkommen | ||
| Homologie-Familie | HOG000192536 | |
| Übergeordnetes Taxon | Bilateria | |
| Orthologe | ||
| Mensch | Hausmaus | |
| Entrez | 5045 | 18550 |
| Ensembl | ENSG00000140564 | ENSMUSG00000030530 |
| UniProt | P09958 | P23188 |
| Refseq (mRNA) | NM_002569 | NM_001081454 |
| Refseq (Protein) | NP_001276752 | NP_001074923 |
| Genlocus | Chr 15: 90.87 – 90.88 Mb | Chr 7: 80.39 – 80.41 Mb |
| PubMed-Suche | 5045 | 18550 |
Zu den Krankheiten, in die Furin involviert ist, gehören unter anderem der Milzbrand, die Vogelgrippe, Krebs, die Alzheimer-Krankheit und das Ebolafieber.[3]
Struktur
Die großen extrazellulären Regionen des Furins weisen eine Gesamthomologie mit denselben Regionen von anderen Mitgliedern der Proprotein-Convertase-Familie auf, die zur Superfamilie der Subtilisin-ähnlichen Serinproteasen gehören. Die größten Sequenzähnlichkeiten befinden sich in der Subtilisin-ähnlichen katalytischen Domäne. Der Aspartat-, Histidin- und Serinrest, die zusammen die katalytische Triade bilden, sind hochkonserviert und die katalytischen Domänen von anderen Proprotein-Convertasen sind mit 54–70 % mit der Sequenz von Furin identisch. Neben einem Signalpeptid besitzen Furin und andere Proprotein-Convertasen sogenannte Prodomänen, an denen sich die Schnittstelle des Signalpeptids am N-Terminus und mehrere konservierte basische Aminosäurereste befinden, welche die autoproteolytische Schnittstelle am C-Terminus beinhalten. Diese essentielle Prodomäne spielt eine wichtige Rolle in der Proteinfaltung von PC, deren Aktivierung, Transport und Regulierung. Des Weiteren besitzen Furin und andere PC eine P-Domäne, die für die Enzymaktivität, die Anpassung am pH-Wert und für die Rekrutierung von Calcium als Cofaktor notwendig ist. In bakteriellen PC fehlt die P-Domäne. Die cytoplasmatische Domäne von Furin kontrolliert dessen Lokalisierung und das Protein Sorting (Prozess, bei dem Proteine auf Basis ihres Bestimmungsorts sortiert werden) im trans-Golgi-Netzwerk.[3]
Eigenschaften
Furin besitzt ein breites pH-Optimum. 50 % seiner enzymatischen Aktivität befindet sich zwischen pH 5 und 8, abhängig davon, welches Substrat gespalten wird. Wie auch andere Mitglieder der Subtilisin-Superfamilie ist Furin streng calciumabhängig und benötigt ungefähr 1 mM Calcium zur vollständigen Funktionsausübung. Außerdem besitzt Furin zwei Calcium-Bindungstaschen, wobei eine Tasche eine mittlere und die andere eine hohe Affinität aufweist.[4] Furin weist außerdem eine schwache Bindung zu Kalium auf; eine Kaliumkonzentration von 20 mM erhöht die Furin-Aktivität durch Erhöhung der Deacylierungsrate (Rückreaktion der Acylierung), die im Katalysezyklus von Furin wichtig ist.[5]
Die Konsensus-Schnittstelle, an der Furin spaltet, befindet sich hinter dem Argininrest am C-Terminus in der Sequenz –Arg–X–Lys/Arg–Arg-|- (wobei X eine beliebige Aminosäure, der senkrechte Strich mit den Viertelgeviertstrichen die Schnittstelle, der Schrägstrich eine „Oder-Verknüpfung“ und der Halbgeviertstrich eine Peptidbindung kennzeichnet) und wurde biochemisch mit zwei Furin-Substraten bestimmt, zum einen mit dem protektiven Antigen (kurz PA, eine Untereinheit des Milzbrandtoxins) und zum anderen mit dem Hämagglutinin des Influenzavirus A (HA).[6][7] Dabei sind die Argininreste an der P1-Position (Aminosäurerest, der sich N-terminal zur Schnittstelle befindet) und P4-Position (vier Aminosäurereste in N-terminaler Richtung von der Schnittstelle entfernt) essentiell, wobei die basische Aminosäure an der P2-Position nicht essentiell ist, aber die Effizienz der enzymatischen Umsetzung stark beeinflussen kann. Daher stellt die Sequenz –Arg–X–X–Arg-|- die Mindestanforderung für eine Schnittsequenz für Furin dar, wobei durch bevorzugte Aminosäurereste an der P2- und P6-Position nicht-bevorzugte Reste an der P4-Position ausgeglichen werden.[8] Aufgrund dessen stellt in Ausnahmefällen die Sequenz –Lys/Arg–X–X–X–Lys/Arg–Arg-|- ebenfalls eine Schnittsequenz für Furin dar.
Die zwei meistverwendeten Furin-Inhibitoren sind der stöchiometrische Peptidylinhibitor Decanoyl–Arg–Val–Lys–Arg–Chlormethylketon und das α1-Antitrypsin Portland (α1-PDX), eine biotechnologisch erzeugte Variante des α1-Antitrypsins. Decanoyl–Arg–Val–Lys–Ar–Chlormethylketon hemmt alle PC mit einer niedrigen nanomolaren Inhibitionskonstante (Ki),[9] wobei die alkylierenden Eigenschaften der reaktiven Gruppe die Anwendungsmöglichkeiten der Reagens einschränken. α1-PDX wird durch Mutation an einer reaktiven Stelle einer Schleife erzeugt, sodass die Mindestanforderung für eine Schnittsequenz für Furin erfüllt ist (–Arg–Ile–Pro–Arg-|-).[10] Außerdem ist α1-PDX hochselektiv für Furin in vitro (Ki = 600 pM); zudem werden bei höheren Konzentrationen auch andere PC gehemmt.[9] In biochemischen, zellulären und tierischen Studien konnte mit α1-PDX die Furin-Aktivität blockiert und die Produktion von pathogenen Viren, die bakterielle Toxinaktivierung und die Krebsmetastase[11] verhindert werden.
Funktion
Das Protein ist ein Enzym, was zur Subtilisin-like-Proprotein-Convertase-Familie gehört. Die Mitglieder dieser Familie sind Proprotein-Convertasen, die latent Präkursor-Proteine zu ihren aktiven Varianten überführen. Es ist eine Calcium-abhängige Serinendoprotease, die sehr effizient Präkursor-Proteine an ihren gepaarten basischen Aminosäuren-Verarbeitungsstellen spalten können. Einige der Furin-Substraten sind Pro-Parathormon, TGF-β1, Pro-Albumin, Pro-Beta-Sekretase, Matrix-Metalloproteinase-1, Beta-NGF und Von-Willebrand-Faktor. Eine Furin-like-Proprotein-Convertase ist mit involviert in der Verarbeitung von RGMc (auch Hämojuvelin genannt), das eine schwere Erkrankung namens juvenile Hämochromatose mit verursachen kann durch Eisen-Überlastung. Forschungsgruppen um Ganz und auch Rotwein demonstrierten, dass Furin-like-Proprotein-Convertase (PPC) verantwortlich sind für die Umwandlung von 50 kDa HJV zu einem 40 kDa Protein mit einem abgeschnittenen COOH-Terminus an einer mehrbasischen RNRR-Stelle. Es deutet auf einen potentiellen Mechanismus zur Generierung von löslichen Formen des Hämojuvelins (s-Hämojuvelin) hin, das im Blut der Nagetiere und Menschen gefunden werden kann.[12][13]
Furin ist eine der Proteasen, die für die proteolytische Spaltung von HIV-Hüllen-Polyprotein-Präkursor gp160 zu gp120 und gp41 im Vorfeld des viralen Zusammenbaus verantwortlich ist.[14] Man glaubt, dass dieses Gen eine Rolle bei der Tumor-Entwicklung spielt. Für dieses Gen wurden Verwendungen von alternativen Polyadenylationsstellen gefunden.[15][16]
Furin ist im Golgi-Apparat reichlich vorhanden, wo es andere Proteine zu ihren reifen/aktiven Formen spaltet.[17] Furin spaltet Proteine nur downstream einer basischen Aminosäure-Zielsequenz (typischerweise Arg-X-(Arg/Lys)-Arg'). Nebst der Prozessierung von zellulären Präkursor-Proteinen wird Furin auch von mehreren Pathogenen benutzt. Zum Beispiel die Hüllen-Proteine der Viren HIV, Influenza, Denguefieber, mehrere Filoviren inkl. Ebola und Marburg-Virus müssen von Furin oder Furin-like-Proteasen gespalten werden, damit sie voll funktional werden können. Beim SARS-CoV-2 Virus wurde die Beteiligung von Furin am Zellzutritt nachgewiesen. Dieses besitzt an seinem Spike-Protein eine Furin-affine Proteinausprägung und wird dort durch Furin gespalten, um den endosomalen Zellzutritt im Lungengewebe einzuleiten.[18][19] Milzbrandtoxin, Pseudomonas-Exotoxin, und Papillomaviren müssen von Furin prozessiert werden während sie die Wirtszelle betreten. Furin-Inhibitoren werden geprüft als therapeutische Mittel zur Behandlung von Anthrax-Infektion.[20]
Die Furin-Substrate und die Positionen der Furin-Spaltungsstellen in Protein-Sequenzen können durch zwei bioinformatische Methoden vorhergesagt werden: ProP[21] und PiTou.[22]
Furin-Expression in T-Zellen ist erforderlich für die Aufrechterhaltung der peripheren Immuntoleranz.[23]
Furin interagiert mit PACS1.[24]
Einzelnachweise
- N. G. Seidah, R. Day, M. Marcinkiewicz, M. Chrétien: Precursor convertases: an evolutionary ancient, cell-specific, combinatorial mechanism yielding diverse bioactive peptides and proteins. In: Annals of the New York Academy of Sciences. Band 839, Mai 1998, S. 9–24, doi:10.1111/j.1749-6632.1998.tb10727.x, PMID 9629127 (Review).
- C. Thacker, A. M. Rose: A look at the Caenorhabditis elegans Kex2/Subtilisin-like proprotein convertase family. In: BioEssays : news and reviews in molecular, cellular and developmental biology. Band 22, Nummer 6, Juni 2000, S. 545–553, doi:10.1002/(SICI)1521-1878(200006)22:6<545::AID-BIES7>3.0.CO;2-F, PMID 10842308 (Review).
- G. Thomas: Furin at the cutting edge: from protein traffic to embryogenesis and disease. In: Nature reviews. Molecular cell biology. Band 3, Nummer 10, Oktober 2002, S. 753–766, doi:10.1038/nrm934, PMID 12360192, PMC 1964754 (freier Volltext) (Review).
- R. J. Siezen, J. W. Creemers, W. J. Van de Ven: Homology modelling of the catalytic domain of human furin. A model for the eukaryotic subtilisin-like proprotein convertases. In: European Journal of Biochemistry. Band 222, Nummer 2, Juni 1994, S. 255–266, doi:10.1111/j.1432-1033.1994.tb18864.x, PMID 8020465.
- N. C. Rockwell, R. S. Fuller: Specific modulation of Kex2/furin family proteases by potassium. In: Journal of Biological Chemistry. Band 277, Nummer 20, Mai 2002, S. 17531–17537, doi:10.1074/jbc.M111909200, PMID 11893737.
- S. S. Molloy, P. A. Bresnahan, S. H. Leppla, K. R. Klimpel, G. Thomas: Human furin is a calcium-dependent serine endoprotease that recognizes the sequence Arg-X-X-Arg and efficiently cleaves anthrax toxin protective antigen. In: Journal of Biological Chemistry. Band 267, Nummer 23, August 1992, S. 16396–16402, PMID 1644824.
- J. A. Walker, S. S. Molloy, G. Thomas, T. Sakaguchi, T. Yoshida, T. M. Chambers, Y. Kawaoka: Sequence specificity of furin, a proprotein-processing endoprotease, for the hemagglutinin of a virulent avian influenza virus. In: Journal of Virology. Band 68, Nummer 2, Februar 1994, S. 1213–1218, PMID 8289354, PMC 236564 (freier Volltext).
- D. J. Krysan, N. C. Rockwell, R. S. Fuller: Quantitative characterization of furin specificity. Energetics of substrate discrimination using an internally consistent set of hexapeptidyl methylcoumarinamides. In: Journal of Biological Chemistry. Band 274, Nummer 33, August 1999, S. 23229–23234, doi:10.1074/jbc.274.33.23229, PMID 10438496.
- F. Jean, K. Stella, L. Thomas, G. Liu, Y. Xiang, A. J. Reason, G. Thomas: alpha1-Antitrypsin Portland, a bioengineered serpin highly selective for furin: application as an antipathogenic agent. In: Proceedings of the National Academy of Sciences. Band 95, Nummer 13, Juni 1998, S. 7293–7298, doi:10.1073/pnas.95.13.7293, PMID 9636142, PMC 22594 (freier Volltext).
- E. D. Anderson, L. Thomas, J. S. Hayflick, G. Thomas: Inhibition of HIV-1 gp160-dependent membrane fusion by a furin-directed alpha 1-antitrypsin variant. In: Journal of Biological Chemistry. Band 268, Nummer 33, November 1993, S. 24887–24891, PMID 8227051.
- S. Molloy, G. Thomas: The Enzymes. Academic Press, San Diego (Kalifornien) 2001, S. 199–235.
- Lin L, Nemeth E, Goodnough JB, Thapa DR, Gabayan V, Ganz T: Soluble hemojuvelin is released by proprotein convertase-mediated cleavage at a conserved polybasic RNRR site. In: Blood Cells, Molecules & Diseases. 40, Nr. 1, 2008, S. 122–31. doi:10.1016/j.bcmd.2007.06.023. PMID 17869549. PMC 2211380 (freier Volltext).
- Kuninger D, Kuns-Hashimoto R, Nili M, Rotwein P: Pro-protein convertases control the maturation and processing of the iron-regulatory protein, RGMc/hemojuvelin. In: BMC Biochemistry. 9, 2008, S. 9. doi:10.1186/1471-2091-9-9. PMID 18384687. PMC 2323002 (freier Volltext).
- Hallenberger S, Bosch V, Angliker H, Shaw E, Klenk HD, Garten W: Inhibition of furin-mediated cleavage activation of HIV-1 glycoprotein gp160. In: Nature. 360, Nr. 6402, November 1992, S. 358–61. doi:10.1038/360358a0. PMID 1360148.
- Entrez Gene: FURIN furin (paired basic amino acid cleaving enzyme).
- Roebroek AJ, Schalken JA, Leunissen JA, Onnekink C, Bloemers HP, Van de Ven WJ: Evolutionary conserved close linkage of the c-fes/fps proto-oncogene and genetic sequences encoding a receptor-like protein. In: The EMBO Journal. 5, Nr. 9, September 1986, S. 2197–202. PMID 3023061. PMC 1167100 (freier Volltext).
- Thomas G: Furin at the cutting edge: from protein traffic to embryogenesis and disease. In: Nature Reviews Molecular Cell Biology. 3, Nr. 10, Oktober 2002, S. 753–66. doi:10.1038/nrm934. PMID 12360192. PMC 1964754 (freier Volltext).
- Hoffmann, Kleine-Weber, Pöhlmann: "A Multibasic Cleavage Site in the Spike Protein of SARS-CoV-2 Is Essential for Infection of Human Lung Cells", In: molecular-cell, 21. Mai 2020, doi:10.1016/j.molcel.2020.04.022
- Coutard B, Valle C, de Lamballerie X, Canard B, Seidah NG, Decroly E: The spike glycoprotein of the new coronavirus 2019-nCoV contains a furin-like cleavage site absent in CoV of the same clade. In: Antiviral Research. 176, Februar 2020, S. 104742. PMID 32057769.
- Shiryaev SA, Remacle AG, Ratnikov BI, Nelson NA, Savinov AY, Wei G, Bottini M, Rega MF, Parent A, Desjardins R, Fugere M, Day R, Sabet M, Pellecchia M, Liddington RC, Smith JW, Mustelin T, Guiney DG, Lebl M, Strongin AY: Targeting host cell furin proprotein convertases as a therapeutic strategy against bacterial toxins and viral pathogens. In: The Journal of Biological Chemistry. 282, Nr. 29, Juli 2007, S. 20847–53. PMID 17537721.
- Duckert P, Brunak S, Blom N: Prediction of proprotein convertase cleavage sites. In: Protein Engineering, Design & Selection. 17, Nr. 1, Januar 2004, S. 107–112. PMID 14985543.
- Tian S, Huajun W, Wu J: Computational prediction of furin cleavage sites by a hybrid method and understanding mechanism underlying diseases. In: Scientific Reports. 2, Februar 2012. doi:10.1038/srep00261. PMID 22355773. PMC 3281273 (freier Volltext).
- Pesu M, Watford WT, Wei L, Xu L, Fuss I, Strober W, Andersson J, Shevach EM, Quezado M, Bouladoux N, Roebroek A, Belkaid Y, Creemers J, O'Shea JJ: T-cell-expressed proprotein convertase furin is essential for maintenance of peripheral immune tolerance. In: Nature. 455, Nr. 7210, September 2008, S. 246–50. doi:10.1038/nature07210. PMID 18701887. PMC 2758057 (freier Volltext).
- Wan L, Molloy SS, Thomas L, Liu G, Xiang Y, Rybak SL, Thomas G: PACS-1 defines a novel gene family of cytosolic sorting proteins required for trans-Golgi network localization. In: Cell. 94, Nr. 2, Juli 1998, S. 205–16. doi:10.1016/S0092-8674(00)81420-8. PMID 9695949.