p-Toluolsulfonsäure
p-Toluolsulfonsäure ist eine organische Sulfonsäure. Sie bildet ein Monohydrat und ist ein wichtiges Reagenz in der organischen Synthese. Ihre Salze und Ester werden Tosylate genannt.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
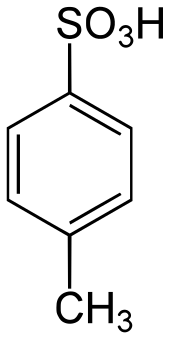 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | p-Toluolsulfonsäure | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | C7H8O3S | |||||||||||||||||||||
| Kurzbeschreibung |
farblose oder violette, stechend riechende Kristalle[2] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse |
| |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Dichte |
1,24 g·cm−3[2] | |||||||||||||||||||||
| Schmelzpunkt |
| |||||||||||||||||||||
| Siedepunkt |
185–187 °C[2] | |||||||||||||||||||||
| Dampfdruck | ||||||||||||||||||||||
| pKS-Wert |
- 2,8[4] | |||||||||||||||||||||
| Löslichkeit |
leicht in Wasser (750 g·l−1)[2] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Darstellung
p-Toluolsulfonsäure stellt ein Nebenprodukt des Remsen-Fahlberg-Verfahrens zur Herstellung von Saccharin dar. Dabei entsteht sie durch Sulfonierung von Toluol. Die Aufreinigung erfolgt durch Kristallisation aus Salzsäure und azeotrope Trocknung.
Eigenschaften
In wässrigen Lösungen ist p-Toluolsulfonsäure weitgehend dissoziiert. Ihre Barium- oder Bleisalze sind, im Gegensatz zu denen der Schwefelsäure, gut in Wasser löslich.[7] p-Toluolsulfonsäure zersetzt sich in der Hitze, wobei u. A. Schwefeldioxid entsteht.
Verwendung
p-Toluolsulfonsäure wird als saurer Katalysator, unter anderem für Acetalisierungen, Veresterungen oder für Dehydratisierungen, eingesetzt.[3] Ihr Vorteil gegenüber Schwefelsäure ist hierbei, dass sie nicht oxidierend und kaum dehydratisierend wirkt. p-Toluolsulfonsäure wird zur Synthese der Pestizide Amitraz, Pretilachlor, Propaquizafop, Pyriproxifen und Triasulfuron benötigt.[8]
Toluolsulfonat als Abgangsgruppe
→ siehe Hauptartikel Tosylgruppe
In der präparativen Chemie tritt das Anion der p-Toluolsulfonsäure als wichtige Abgangsgruppe bei nukleophilen Substitutionen auf. Mit dem Säurehalogenid p-Toluolsulfonsäurechlorid (Tosylchlorid), lassen sich Hydroxygruppen einer Verbindung zu Sulfonsäureestern überführen. Diese Gruppe ist im Vergleich zur Hydroxygruppe eine gute Abgangsgruppe.
Gefahren
p-Toluolsulfonsäure enthält aufgrund der industriellen Herstellung meist etwas Schwefelsäure und wirkt in wässriger Lösung ätzend auf Haut, Schleimhäute und Augen. Beim Einatmen des Staubs besteht die Gefahr eines Lungenödems.
Siehe auch
Einzelnachweise
- Eintrag zu TOLUENE SULFONIC ACID in der CosIng-Datenbank der EU-Kommission, abgerufen am 11. Mai 2020.
- Eintrag zu Toluol-4-sulfonsäure (mit höchstens 5 Prozent Schwefelsäure) in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2021. (JavaScript erforderlich)
- Eintrag zu Methylbenzolsulfonsäuren. In: Römpp Online. Georg Thieme Verlag, abgerufen am 18. April 2012.
- Guthrie, J. P.: Hydrolysis of esters of oxy acids: pKa values for strong acids. In: Can. J. Chem. 1978, 56, 2342-2354.
- Eintrag zu Toluene-4-sulphonic acid im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Datenblatt P-Toluolsulfonsäure (PDF) bei Merck, abgerufen am 19. Januar 2011.
- Beyer-Walter: Lehrbuch der Organischen Chemie, 23. Auflage, S. Hirzel Verlag 1998 ISBN 3-7776-0808-4.
- Thomas A. Unger: Pesticide Synthesis Handbook. William Andrew, 1996, ISBN 0-8155-1853-6, S. 1050 (Vorschau).
