Cyclopropancarbaldehyd
Cyclopropancarbaldehyd ist das kleinste Cycloalkan, das eine Formylgruppe trägt, die direkt mit der Cyclopropylgruppe verknüpft ist. Die Verbindung ist ein Molekülbaustein (building block) für das Dinitroanilin-Herbizid Profluralin und für Cyclopropylacetylen, eine wichtige Zwischenstufe (intermediate) für das HIV-Therapeutikum Efavirenz.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
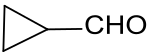 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Cyclopropancarbaldehyd | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C4H6O | |||||||||||||||
| Kurzbeschreibung | ||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 70,09 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||
| Dichte | ||||||||||||||||
| Siedepunkt | ||||||||||||||||
| Löslichkeit |
vollständig in Wasser, Ethanol und Diethylether[3], sowie in Dichlormethan[5] löslich | |||||||||||||||
| Brechungsindex |
1,4298 (20 °C)[3] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Herstellung
Die Oxidation von Cyclopropylmethanol mit wässriger Ammoniumcer(IV)-nitrat (NH4)2[Ce(NO3)6] liefert Cyclopropancarboxaldehyd in 64%iger Ausbeute.[6]
Bereits beim Schütteln mit auf Aluminiumsilikat aufgezogenem Kaliumpermanganat entsteht aus Cyclopropanmethanol CPCA in 89%iger Ausbeute.[7]
Das durch Acyloin-Kondensation von Bernsteinsäurediethylester[8] einfach zugängliche 2-Hydroxycyclobutanon kann mit Lithiumaluminiumhydrid zum 1,2-Cyclobutandiol hydriert werden, das mit Bortrifluorid-dibutyletherat bei 230 °C unter Wasserabspaltung und Ringverengung in 65 – 80%iger Ausbeute zu Cyclopropancarboxaldehyd reagiert.[5]
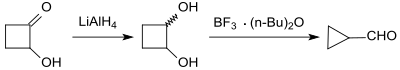
Durch thermische Umlagerung von 2,3-Dihydrofuran bei Temperaturen von 200 bis 300 °C, erhöhtem Druck (4,5 bar) und in Gegenwart eines Aluminiumoxid-Katalysators entsteht ein destillativ nicht trennbares Gemisch aus ca. 90 % Cyclopropancarbaldehyd (durch Ringverengung) und ca. 10 % Crotonaldehyd mit Sdp. 102,4 °C durch Ringöffnung.[9]
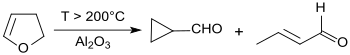
Die Trennung des Stoffgemischs gelingt durch katalytische Hydrierung des reaktiveren Crotonaldehyds zu Butanal (Sdp. 75 °C) und anschließende Destillation.[10]
Eine Alternative dazu stellt die Umsetzung des Gemischs mit einem sekundären Amin, z. B. Dicyclohexylamin dar, wobei mit Crotonaldehyd überwiegend Höhersieder entstehen, die bei der destillativen Abtrennung des reinen CPCA im Sumpf verbleiben.[11]
Eigenschaften
Cyclopropancarboxaldehyd ist eine klare farblose bis gelbe, stinkende Flüssigkeit, die sich vollständig mit Wasser und mit vielen organischen Lösungsmitteln, wie z. B. Ethanol, Diethylether oder Methylenchlorid mischt.
Anwendungen
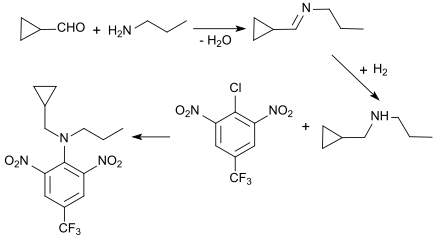
Durch reduktive Aminierung von CPCA mit Propylamin und Wasserstoff in Gegenwart von Platin als Katalysator wird Cyclopropylmethyl-N-propylamin als Vorstufe des Herbizids Profluralin (TolbanR) dargestellt.[12]
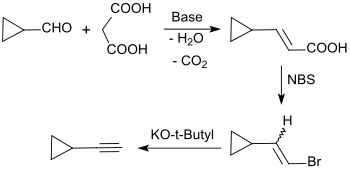
Die mehrstufige Synthese von Cyclopropylacetylen (Ethinylcyclopropan) als Molekülbaustein für das Virustatikum Efavirenz geht aus von Cyclopropancarbaldehyd, der mit Malonsäure zur Cyclopropylacrylsäure reagiert. Die Bromierung mit N-Bromsuccinimid liefert Cyclopropylvinylbromid, das mit Kalium-tert-butanolat in Dimethylsulfoxid in 80%iger Ausbeute zu Cyclopropylacetylen dehydrobromiert wird.[13]
Eine dreistufige alternative Cyclopropanacetylen-Synthese, ausgehend von CPCA, verläuft über die Addition von Trichloressigsäure zum α-(Trichlormethyl)cyclopropanmethanol, das mit para-Toluolsulfonsäurechlorid zum Tosylat umgesetzt wird. Daraus wird mit Methyllithium Chlorid, Tosylat und Chlorwasserstoff abgespalten unter Bildung von Ethinylcyclopropan.[14]
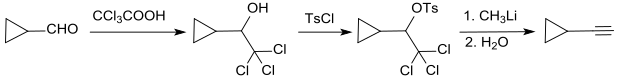
Die Methode eignet sich auch für die Darstellung von 1-Alkinen aus den entsprechenden Aldehyden in guten bis sehr guten Ausbeuten.
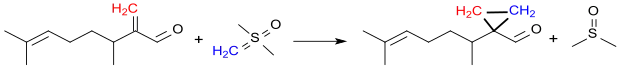
Einige alkenylsubstituierte Cyclopropancarboxaldehyde, wie z. B. die Verbindung 1-(1,5-Dimethyl-4-hexenyl)-cyclopropancarboxaldehyd, eignen sich aufgrund ihres blumigen Geruchs als Parfumkomponenten.[15] Solche substituierten Cyclopropancarbaldehyde werden nicht aus CPCA erhalten, sondern sind durch Johnson-Corey-Chaykovsky-Reaktion z. B. der Cyclopropanierung von 3,7-Dimethyl-2-methylene-oct-6-enal mit Dimethyloxosulfoniummethylid – aus Trimethyloxosulfoniumiodid mit Natriumhydrid analog der Vorschrift[16] zugänglich.
Einzelnachweise
- Datenblatt Cyclopropanecarboxaldehyde bei AlfaAesar, abgerufen am 30. März 2018 (PDF) (JavaScript erforderlich).
- Eintrag zu Cyclopropanecarboxaldehyde bei TCI Europe, abgerufen am 30. März 2018.
- William M. Haynes: CRC Handbook of Chemistry and Physics, 97th Edition. CRC Press, Boca Raton, FL, U.S.A. 2017, ISBN 978-1-4987-5429-3, S. 3–138.
- Datenblatt Cyclopropanecarboxaldehyde 98% bei Sigma-Aldrich, abgerufen am 30. März 2018 (PDF).
- J.P. Barnier, J. Champion, J.M. Conia: Cyclopropanecarboxaldehyde In: Organic Syntheses. 60, 1981, S. 25, doi:10.15227/orgsyn.060.0025; Coll. Vol. 7, 1990, S. 129 (PDF).
- L.B. Young, W.S. Trahanovsky: Cerium(IV) oxidation of organic compounds. III. Preparation of cyclopropanecarbaldehyde from cyclopropanemethanol. In: J. Org. Chem. Band 32, Nr. 7, 1967, S. 2349–2350, doi:10.1021/jo01282a058.
- J.-D. Lou, C.-L. Gao, L. Li. Z.-G. Fang: An Efficient Selective Oxidation of Alcohols with Potassium Permanganate Adsorbed on Aluminum Silicate under Solvent-free Conditions and Shaking. In: Monatsh. Chem. Band 137, Nr. 8, 2006, S. 1071–1074, doi:10.1007/s00706-006-0506-0.
- J.J. Bloomfield, J.M. Nelke: Acyloin condensation in which trichloromethylsilane is used as a trapping agent: 1,2-bis(trimethylsilyloxy)cyclobutene and 2-hydroxycyclobutanone In: Organic Syntheses. 75, 1977, S. 1, doi:10.15227/orgsyn.057.0001; Coll. Vol. 6, 1988, S. 167 (PDF).
- Patent US5633410: Process for the conversion of 2,3-dihydrofuran to cyclopropanecarboxaldehyde. Angemeldet am 30. August 1996, veröffentlicht am 27. Mai 1997, Anmelder: Eastman Chemical Co., Erfinder: S. Liang, T.W. Price.
- Patent US5471003: Purification of cyclopropanecarboxaldehyde. Angemeldet am 28. November 1994, veröffentlicht am 28. November 1995, Anmelder: Eastman Chemical Co., Erfinder: S. Liang.
- Patent US6353140B1: Process for the purification of cyclopropancarboxaldehyde. Angemeldet am 8. Juni 2001, veröffentlicht am 5. März 2002, Anmelder: Eastman Chemical Co., Erfinder: S.N. Falling, S.E. Large, R.J. Maleski.
- Patent US4275238: Process for the preparation of cyclopropylmethyl-N-propylamine. Angemeldet am 10. Januar 1980, veröffentlicht am 23. Juni 1981, Anmelder: Ciba-Geigy Corp., Erfinder: H.E. Petree, J.B. Nabors.
- Patent US6297410B1: Process for the preparation of cyclopropylacetylene. Angemeldet am 12. Januar 2000, veröffentlicht am 2. Oktober 2001, Anmelder: DuPont Pharmaceutical Co., Erfinder: J.M. Fortunak, Z. Wang, J. Yin.
- Z. Wang, S. Campagna, K. Yang, G. Xu, M.E. Pierce, J.M. Fortunak, P.N. Confalone: A practical preparation of terminal alkynes from aldehydes. In: J. Org. Chem. Band 65, Nr. 6, 2000, S. 1889–1891, doi:10.1021/jo9916582.
- Patent US7087796B1: Cyclopropane carboxaldehydes and their use in perfume compositions. Angemeldet am 16. Juni 2005, veröffentlicht am 8. August 2006, Anmelder: International Flavors & Fragrances Inc., Erfinder: A.P.S. Narula, E.M. Arruda, F.T. Schiet.
- E.J. Corey, M. Chaykovsky: Methylenecyclohexane oxide In: Organic Syntheses. 49, 1969, S. 78, doi:10.15227/orgsyn.049.0078; Coll. Vol. 5, 1973, S. 755 (PDF).

