Efavirenz
Efavirenz (EFV, Handelsnamen Sustiva, Stocrin; Hersteller: Bristol-Myers Squibb) ist ein Arzneistoff zur Behandlung von HIV-1-infizierten Patienten im Rahmen einer antiretroviralen Kombinationstherapie.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
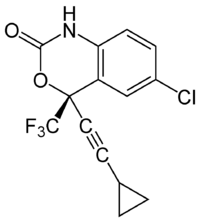 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Freiname | Efavirenz | ||||||||||||||||||
| Andere Namen |
(4S)-6-Chlor-4-(2-cyclopropylethinyl)-4-(trifluormethyl)-2H-3,1-benzoxazin-2-on | ||||||||||||||||||
| Summenformel | C14H9ClF3NO2 | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Arzneistoffangaben | |||||||||||||||||||
| ATC-Code | |||||||||||||||||||
| Wirkstoffklasse |
Virustatikum, nichtnukleosidische Reverse-Transkriptase-Inhibitoren | ||||||||||||||||||
| Wirkmechanismus |
nicht-kompetitive Hemmung der reversen Transkriptase | ||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 315,67 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Efavirenz gehört zur Gruppe der nichtnukleosidischen Reverse-Transkriptase-Inhibitoren (NNRTI).
Entwicklung und Vermarktung
Efavirenz wurde für die USA von der amerikanischen Food and Drug Administration im September 1998 als Sustiva, in der EU im Mai 1999 (Sustiva, Stocrin) zugelassen. In Deutschland wird das Präparat von Bristol-Myers Squibb seit 1999 vermarktet. Efavirenz ist der zweite Vertreter aus der Gruppe NNRTI und muss nur einmal täglich eingenommen werden. Verfügbar ist es als Filmtablette oder Kapsel,[3] die Lösung zum Einnehmen wurde Ende Oktober 2015 eingestellt.[4]
Im Jahr 2007 wurde in der EU die fixe Kombination mit Emtricitabin und Tenofovir (Atripla, gemeinsame Entwicklung von Bristol-Myers Squibb und Gilead Sciences) zugelassen für die antiretrovirale Kombinationstherapie (cART) mit einer einzigen Tablette pro Tag.[5]
Chemie
Efavirenz ist chiral, das Enantiomer (4R)-6-Chlor-4-cyclopropylethinyl-4-trifluormethyl-1,4-dihydro-2H-3,1-benzoxazin-2-on[6] wird pharmazeutisch nicht verwendet.
Die vielstufige Synthese von Efavirenz, inklusive der Racematspaltung einer Zwischenstufe, ist in der Literatur beschrieben.[7] Die enantioselektive Synthese ermöglicht ein von Jiang et al. beschriebenes Verfahren.[8]
Wirkungsweise
Efavirenz gehört zur Substanzklasse der nichtnukleosidische Reverse-Transkriptase-Inhibitoren. Der Wirkstoff bindet nicht-kompetitiv an die Reverse Transkriptase von HIV-I, nahe der Substratbindungsstelle für Nukleoside. Dadurch wird die katalytisch aktive Bindungsstelle blockiert. Es können nur wenige Nukleoside binden und die Polymerisation wird deutlich verlangsamt.
Klinische Angaben
Pharmakokinetik
Die maximale Plasmakonzentration ist nach etwa 5 Stunden erreicht. Die Nahrungsaufnahme hat in der Regel keine Auswirkung auf die Resorption. Die Ausnahme sind sehr fettreiche Mahlzeiten, die die Resorption um durchschnittlich 50 % erhöhen. Die Bindung an Plasmaeiweiß beträgt > 99 %. Die Liquor-Konzentration ist etwa dreimal so hoch wie die freie Efavirenz-Konzentration im Plasma. Die Halbwertzeit liegt zwischen 40 und 55 Stunden. Die Ausscheidung erfolgt zu 14–34 % im Urin in Form von Metaboliten und zu 16–61 % im Stuhl als unveränderte Substanz.
Gegenanzeigen
In der Schwangerschaft oder bei Kinderwunsch der Patientinnen darf Efavirenz nicht zur Therapie eingesetzt werden, da es fruchtschädigend ist.
Patienten mit schwerer Leberschädigung (Child-Pugh-Score „C“) dürfen ebenfalls nicht mit Efavirenz behandelt werden. Auch die gleichzeitige Anwendung mit einer Reihe von Arzneistoffen, die durch Konkurrenz bei der Verstoffwechselung durch CYP3A4 schwerwiegende bis lebensbedrohliche Nebenwirkungen zur Folge haben kann, ist kontraindiziert.
Nebenwirkungen
Efavirenz kann vor allem in den ersten Behandlungstagen ZNS-Symptome wie Benommenheit, Kopfschmerzen, Konzentrationsschwäche, Schlafstörungen oder ungewöhnliche Träume verursachen. In den meisten Fällen sind die ZNS-Symptome nur leicht oder mittelschwer und gehen ohne Therapieunterbrechung oder Dosisreduktion nach zwei bis vier Wochen zurück.[3] Eine Therapie mit Efavirenz kann das Risiko für einen Suizid des Patienten erhöhen.[9]
Efavirenz kann bei Urintests zum Screening auf Cannabinoide zu falsch-positiven Testergebnissen führen.
Handelsnamen
Stocrin (A, CH), Sustiva (D,[10] A), diverse Generika
- mit Emtricitabin und Tenofovirdisoproxil: Atripla (D, A), diverse Generika
Weblinks
- Liste der Antiretrovirale Medikamente der Deutschen AIDS-Hilfe (Stand: 1. März 2019)
- Öffentlicher Beurteilungsbericht (EPAR) der europäischen Arzneimittelagentur (EMA) zu Stocrin und zu Sustiva
Einzelnachweise
- The Merck Index. An Encyclopaedia of Chemicals, Drugs and Biologicals. 14. Auflage, 2006, S. 698, ISBN 978-0-911910-00-1.
- Für diesen Stoff liegt noch keine harmonisierte Einstufung vor. Wiedergegeben ist eine von einer Selbsteinstufung durch Inverkehrbringer abgeleitete Kennzeichnung von 153789 im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 16. Januar 2020.
- Efavirenz: HIV-Patienten profitieren von einmal täglicher Einnahme. 22. November 1998, abgerufen am 8. August 2020.
- Ankündigung der Einstellung des Vertriebs von SUSTIVA 30 mg/ml Lösung zum Einnehmen Ende Oktober 2015, Herstellermitteilung vom 30. April 2015 (PDF).
- B. Sauer: Einfachere HIV-Therapie. In: Pharmazeutische Zeitung. Band 12, 2008 (pharmazeutische-zeitung.de).
- Externe Identifikatoren von bzw. Datenbank-Links zu (4R)-6-Chlor-4-cyclopropylethinyl-4-trifluormethyl-1,4-dihydro-2H-3,1-benzoxazin-2-on: CAS-Nummer: 154801-74-8, PubChem: 477099, ChemSpider: 418787, Wikidata: Q27275423.
- Lilian A. Radesca, Young S. Lo, James R. Moore und Michael E. Pierce: Synthesis of HIV-1 Reverse Transcriptase Inhibitor DMP 266, Synthetic Communications 27 (1997) 4373–4384. doi:10.1080/00397919708005064
- B. Jiang, Y.G. Si: Highly Enantioselective Construction of a Chiral Tertiary Carbon Center by Alkynylation of a Cyclic N‐Acyl Ketimine: An Efficient Preparation of HIV Therapeutics, Angewandte Chemie 43, 2003, 216–218. doi:10.1002/anie.200352301
- Katie R. Mollan et al.: Association Between Efavirenz as Initial Therapy for HIV-1 Infection and Increased Risk for Suicidal Ideation or Attempted or Completed Suicide. In: Annals of Internal Medicine. Band 161, 2. Januar 2014, doi:10.7326/M14-0293 (englisch).
- Rote Liste Service GmbH (Hrsg.): Rote Liste 2017 – Arzneimittelverzeichnis für Deutschland (einschließlich EU-Zulassungen und bestimmter Medizinprodukte), Rote Liste Service GmbH, Frankfurt/Main, 2017, Aufl. 57, ISBN 978-3-946057-10-9, S. 179.
Literatur
- Cozzi-Lepri, A. et al. (2002): Virologic and immunologic response to regimens containing nevirapine or efavirenz in combination with 2 nucleoside analogues in the (I.Co.N.A.) study. J Infect Dis 185(8); 1062–9; PMID 11930316.
- Fisac, C. et al. (2005): Metabolic benefits 24 months after replacing a protease inhibitor with abacavir, efavirenz or nevirapine. AIDS. 19(9); 917–25; PMID 15905672.
- Fumaz, CR. et al. (2002): Quality of life, emotional status, and adherence of HIV-1-infected patients treated with efavirenz versus PI-containing regimens. J Acquir Immune Defic Syndr. 29(3); 244–53; PMID 11873073.
- Gallego, L. et al. (2004): Analyzing sleep abnormalities in HIV-infected patients treated with Efavirenz. Clin Infect Dis. 38(3); 430–2; PMID 14727217.
- Haas, DW. et al. (2004): Pharmacogenetics of efavirenz and central nervous system side effects: an Adult AIDS Clinical Trials Group study. AIDS. 18(18); 2391–2400. PMID 15622315.
- Lochet, P. et al. (2003): Long-term assessment of neuropsychiatric adverse reactions associated with efavirenz. HIV Medicine 4(1); 62–6. PMID 12534961; doi:10.1046/j.1468-1293.2003.00136 (freier Volltextzugriff, engl.).
- Martinez, E. et al. (2003): Substitution of nevirapine, efavirenz or abacavir for protease inhibitors in patients with HIV infection. N Engl J Med. 349(11); 1036–46; PMID 12968087; PDF (freier Volltextzugriff, engl.).
- Marzolini, C. et al. (2001): Efavirenz plasma levels can predict treatment failure and central nervous system side effects in HIV-1-infected patients. AIDS. 15(1); 71–5; PMID 11192870.
- Sheran, M. The NNRTIs efavirenz and nevirapine in the treatment of HIV. HIV Clin Trials. 6(3); 158–68; PMID 16192249.
- Squires, K. et al. (2004): Comparison of once-daily atazanavir with efavirenz, each in combination with fixed-dose zidovudine and lamivudine, as initial therapy for patients infected with HIV. J Acquir Immune Defic Syndr. 36(5); 1011–1019; PMID 15247553.
- Staszewski, S. et al. (1999): Efavirenz plus zidovudine and lamivudine, efavirenz plus indinavir, and indinavir plus zidovudine and lamivudine in the treatment of HIV-1 infection in adults. N Engl J Med. 341(25); 1865–73; PMID 10601505; PDF (freier Volltextzugriff, engl.).
- Sulkowski, MS. et al. (2002): Hepatotoxicity associated with nevirapine or efavirenz-containing antiretroviral therapy: role of hepatitis C and B infections. Hepatology 35(1); 182–9; PMID 11786975; doi:10.1053/jhep.2002.30319 (freier Volltextzugriff, engl.).
- Sütterlin, S., Vögele, C., & Gauggel, S. (2010). Neuropsychiatric complications of Efavirenz therapy: suggestions for a new research paradigm. The Journal of Neuropsychiatry and Clinical Neurosciences, 22(4), 361-369. PMID 21037119.
- Torre, D. et al. (2001): Nevirapine or efavirenz combined with two nucleoside reverse transcriptase inhibitors compared to HAART: a meta-analysis of randomized clinical trials. HIV Clin Trials. 2(2); 113–21; PMID 11590519.
- van Leth, F. et al. (2004): Comparison of first-line antiretroviral therapy with regimens including nevirapine, efavirenz, or both drugs, plus stavudine and lamivudine: a randomised open-label trial, the 2NN Study. Lancet 363(9417); 1253–63; PMID 15094269.
- Winston, A. et al. (2004): Dose escalation or immediate full dose when switching from efavirenz to nevirapine-based highly active antiretroviral therapy in HIV-1-infected individuals? AIDS 18(3); 572–4; PMID 15090815.