para-Toluolsulfonsäurechlorid
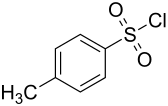
para-Toluolsulfonsäurechlorid ist eine chemische Verbindung aus der Gruppe der Sulfonsäuren. Sie ist das Säurechlorid der para-Toluolsulfonsäure und wird umgangssprachlich oft als Tosylchlorid, geschrieben TsCl, bezeichnet. Dabei steht die Abkürzung „Ts“ für eine Tosylgruppe.[4]
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | para-Toluolsulfonsäurechlorid | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C7H7ClO2S | ||||||||||||||||||
| Kurzbeschreibung |
hellgrauer Feststoff mit charakteristischem Geruch[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 190,64 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
1,49 g·cm−3[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
135 °C (13 hPa)[1] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
Zersetzung mit Wasser[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Darstellung
Die Verbindung kann durch eine Reaktion ähnlich einer Friedel-Crafts-Alkylierung aus Toluol hergestellt werden. Hierzu wird Toluol mit Sulfurylchlorid und Aluminiumchlorid als Katalysator zur Reaktion gebracht.[5]
Eine weitere Möglichkeit besteht in der Umsetzung von para-Methylanilin in einer Sandmeyer-ähnlichen Reaktion. Hierzu wird das Amin zunächst mit Natriumnitrit diazotiert. Das entstandene Diazoniumsalz wird dann mit Schwefeldioxid in Gegenwart von Kupfer(I)-chlorid und Magnesiumchlorid zur Reaktion gebracht.[6]
Tosylchlorid ist ein Abfallprodukt der Saccharin-Herstellung. Hier entstehen neben dem hierfür benötigte o-Toluolsulfonylchlorid auch das p-Toluolsulfonylchlorid, das nach der Trennung voneinander als Feinchemikalie veräußert wird.[7]
Eigenschaften
para-Toluolsulfonsäurechlorid ist ein ätzender Feststoff mit einem charakteristischen eigentümlichem Geruch, der bei 67 °C schmilzt und bei 135 °C bei einem Druck von 13 hPa siedet. Ab einer Temperatur von 220 °C zersetzt er sich.[1] Eine DSC-Messung zeigt ab 249 °C eine stark exotherme Zersetzungsreaktion mit einer Wärmetönung von −451 kJ·kg−1 bzw. −86 kJ·mol−1.[8]
Verwendung
Tosylate können durch Deprotonierung eines Alkohols und anschließender Reaktion mit p-Toluolsulfonsäurechlorid hergestellt werden, wobei ein Äquivalent Chlorwasserstoff, der durch eine Base als Hydrochlorid gebunden wird, entsteht:
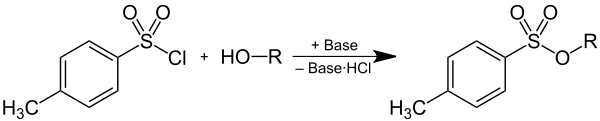
Auf Grund ihrer Eigenschaft als Abgangsgruppe werden Tosylate als Zwischenprodukte in der präparativen Organischen Chemie verwendet. Durch Überführung von Alkoholen in Tosylate wird die schlechte Abgangsgruppe HO− in eine gute Abgangsgruppe überführt, wodurch Substitutionsreaktionen an dieser Position des Kohlenstoffgerüstes ermöglicht werden. Das Anion (= Tosylat) der p-Toluolsulfonsäure tritt dabei als Abgangsgruppe aus.
Literatur
- Reinhard Brückner: Reaktionsmechanismen. 3. Auflage, Spektrum Akademischer Verlag, München 2004, ISBN 3-8274-1579-9.
- Autorenkollektiv: Organikum. 22. Auflage. Wiley-VCH, 2004, ISBN 978-3-527-31148-4.
Einzelnachweise
- Eintrag zu Toluol-4-sulfonylchlorid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 10. Januar 2017. (JavaScript erforderlich)
- OECD: Screening Information Dataset (SIDS) Initial Assessment Report (SIAR) für Benzenesulfonyl chloride, 4-methyl-, abgerufen am 15. Juni 2017.
- Datenblatt Para-Toluolsulfonsäurechlorid (PDF) bei Merck, abgerufen am 18. Januar 2011.
- Paula Yurkanis Bruice: Organic Chemistry, Pearson Education Inc., 2004, 4. Auflage, S. 444, ISBN 0-13-121730-5.
- A. Töhl, O. Eberhard: Ueber die Einwirkung des Sulfurylchlorids auf aromatische Kohlenwasserstoffe, in: Chem. Ber. 1893, 26, 2940–2945; doi:10.1002/cber.189302603118.
- H. Meerwein, G. Dittmar, R. Göllner, K. Hafner, F. Mensch, O. Steinfort: Untersuchungen über aromatische Diazoverbindungen, II. Verfahren zur Herstellung Aromatischer Sulfonsäurechloride, Eine Neue Modifikation der Sandmeyerschen Reaktion, in: Chem. Ber. 1957, 90, 841–852; doi:10.1002/cber.19570900602.
- H. Beyer, W. Walter: Lehrbuch der organischen Chemie, S. Hirzel Verlag, Stuttgart 1981, 19. Auflage, S. 514; ISBN 3-7776-0356-2.
- Sperry, J.B.; Minteer, C.J.; Tao, J.; Johnson, R.; Duzguner, R.; Hawksworth, M.; Oke, S.; Richardson, P.F.; Barnhart, R.; Bill, D.R.; Giusto, R.A.; Weaver, J.D.: Thermal Stability Assessment of Peptide Coupling Reagents Commonly Used in Pharmaceutical Manufacturing in Org. Process Res. Dev. 22 (2018) 1262–1275, doi:10.1021/acs.oprd.8b00193.

