Lumiracoxib
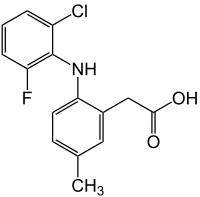
Lumiracoxib ist ein Arzneistoff aus der Gruppe der Cyclooxygenase-2-Hemmer (auch COX-2-Hemmer oder Coxibe genannt), der in der Behandlung von Symptomen bei aktivierter Arthrose des Knie- und Hüftgelenks eingesetzt wurde. Im Unterschied zu den anderen selektiven COX-2-Hemmern ähnelt seine Struktur der von Diclofenac.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Freiname | Lumiracoxib | |||||||||||||||
| Andere Namen |
2-[(2-Chlor-6-fluor-phenyl)amino]-5-methyl-phenylessigsäure (IUPAC) | |||||||||||||||
| Summenformel | C15H13ClFNO2 | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||
| ATC-Code |
M01AH06 | |||||||||||||||
| Wirkstoffklasse |
Coxibe | |||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 293,72 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Lumiracoxib wurde in Deutschland im November 2006 in Form von Tabletten (Prexige® 100 mg) nach einem nicht zentralisierten EU-Verfahren zugelassen. Im November 2007 ordnete das Bundesinstitut für Arzneimittel und Medizinprodukte das Ruhen der Zulassung an.[3] Am 28. März 2008 schließlich wurde die Zulassung aufgrund eines Beschlusses der Europäischen Kommission vollständig widerrufen.[4]
Klinische Angaben
Lumiracoxib 100 mg wird für die Behandlung von Symptomen bei aktivierter Arthrose des Knie- und Hüftgelenks bei Patienten ab 18 Jahren verwendet. Die Dosierung beträgt 1 × täglich 1 Tablette (100 mg).
Pharmakologische Eigenschaften
Der Wirkstoff wird schnell resorbiert und hat eine relativ kurze Plasmahalbwertszeit von 4 bis 6 Stunden, das heißt, Lumiracoxib kumuliert nicht. Der Wirkstoff ist eine Carbonsäure, diese reichert sich im entzündeten Zielgewebe an und lässt sich dort über 24 Stunden nachweisen. Dies ermöglicht eine 24-Stunden-Therapie mit einer einmal täglichen Dosierung.
Sonstige Informationen
Chemische Informationen
Lumiracoxib wurde vom nichtselektiven COX-Hemmer Diclofenac abgeleitet, das als Standardtherapeutikum in der Behandlung rheumatischer Erkrankungen eingesetzt wird. Lumiracoxib ist das bisher einzige Coxib ohne Sulfon- oder Sulfonsäureamid-Struktur. Das heißt, dass auf diese Strukturen zurückführbare allergische Reaktionen nicht auftreten können.
Marktrücknahme
Aufgrund von Berichten über schwere Leberreaktionen wurde Lumiracoxib (Tabletten zu 100 mg, 200 mg und 400 mg) in Australien vom Markt genommen. Bei der australischen Gesundheitsbehörde (Therapeutic Goods Administration, TGA) waren zwischen März und August 2007 acht Berichte über schwere Leberschädigungen einschließlich zweier Todesfälle und zweier Lebertransplantationen eingegangen.[5][6] Neuseeland folgte mit der Marktrücknahme für die Stärke 200 mg und 400 mg.[7] Auch in Kanada wurde Lumiracoxib im Oktober 2007 aufgrund von Fällen von schwerer Leberschädigung vom Markt genommen. In den USA wurde das Arzneimittel nicht zugelassen. Die dortige Arzneimittelbehörde FDA (Food and Drug Administration) lehnte im September 2007 die Zulassung ab.
Mitte November 2007 wurde in Deutschland und Großbritannien durch die Arzneimittelbehörden bis auf Weiteres das Ruhen der Zulassung angeordnet, auch in Österreich wurde der Vertrieb eingestellt. Im Dezember 2007 hat die Europäische Arzneimittelagentur die Rücknahme der Zulassung im gesamten EU-Markt empfohlen.[8]
Studie
- Thomas J. Schnitzer, Gerd R. Burmester, Eduardo Mysler, Marc C. Hochberg, Michael Doherty, Elena Ehrsam, Xavier Gitton, Gerhard Krammer, Bernhard Mellein, Patrice Matchaba, Alberto Gimona, Christopher J. Hawkey: Comparison of lumiracoxib with naproxen and ibuprofen in the Therapeutic Arthritis Research and Gastrointestinal Event Trial (TARGET), reduction in ulcer complications: randomised controlled trial. In: The Lancet, Band 364, Nr. 9435, 2004, S. 665–674, PMID 15325831, doi:10.1016/S0140-6736(04)16893-1.
Weblinks
- Prexige von Novartis. (PDF; 178 kB) Rote-Hand-Brief.
Einzelnachweise
- The Merck Index. An Encyclopaedia of Chemicals, Drugs and Biologicals. 14. Auflage. 2006, S. 971, ISBN 978-0-911910-00-1.
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Lumiracoxib (Prexige®): Das BfArM ordnet das Ruhen der Zulassung an. BfArM, 19. November 2007, abgerufen am 26. Februar 2017.
- Lumiracoxib (Prexige®): Das BfArM ordnet den Widerruf der Zulassung an. (Nicht mehr online verfügbar.) BfArM, 28. März 2008, archiviert vom Original am 26. Februar 2017; abgerufen am 26. Februar 2017.
- Lumiracoxib (Prexige®): Marktrücknahme in Australien wegen schwerer Leberschädigung. (Nicht mehr online verfügbar.) BfArM, 14. August 2007, archiviert vom Original am 27. Februar 2017; abgerufen am 26. Februar 2017.
- Medicines Regulator cancels registration of anti inflammatory drug, Lumiracoxib (Prexige) (Memento vom 3. Juni 2009 im Internet Archive).
- Prexige 200mg and 400mg tablets to be withdrawn in New Zealand. New Zealand Medicines and Medical Devices Safety Authority, 21. August 2007, abgerufen am 26. Februar 2017 (englisch).
- European Medicines Agency recommends withdrawal of the marketing authorisations for lumiracoxib-containing medicines. EMEA, 13. Dezember 2007, abgerufen am 26. Februar 2017 (englisch).