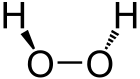Carbamidperoxid
Carbamidperoxid (Wasserstoffperoxid-Harnstoff-Addukt) ist ein wasserlösliches kristallines Addukt, das sich bei der Umkristallisation von Harnstoff mit konzentrierter (30-prozentiger) Wasserstoffperoxid-Lösung bildet und ca. 35 % Wasserstoffperoxid enthält. Das Addukt bietet als festes und wasserfreies Wasserstoffperoxid mit höherer Stabilität und besserer Steuerbarkeit Vorteile gegenüber flüssigem Wasserstoffperoxid als Oxidationsmittel.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
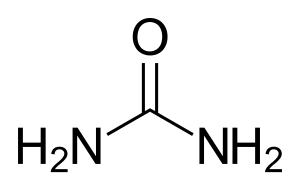
| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Carbamidperoxid | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | CH6N2O3 | |||||||||||||||||||||
| Kurzbeschreibung |
weißes Kristallpulver[2] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 94,07 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Dichte | ||||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Dampfdruck |
31,1 hPa bei 30 °C[3] | |||||||||||||||||||||
| Löslichkeit | ||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Herstellung
Zur Herstellung von Carbamidperoxid wird Harnstoff – der gegen Oxidationsmittel wie Wasserstoffperoxid stabil ist – in 30-prozentigem Wasserstoffperoxid (Molverhältnis 2:3) unter Erwärmen auf Temperaturen unter 60 °C gelöst. Beim Abkühlen fällt das Addukt in Form kleiner Plättchen aus.[6]

Die Gehaltsbestimmung durch Titration mit Kaliumpermanganat-Lösung ergibt einen Wasserstoffperoxidgehalt von 35,4 % oder 97,8 % des theoretischen Maximalwerts von 36,2 %. Die restliche Verunreinigung besteht aus Harnstoff.
Das Addukt kann durch Zugabe von ca. 1 % Natriumpyrophosphat, Natriumhexametaphosphat, Weinsäure oder EDTANa2, die katalytisch wirksame Schwermetallionen komplexieren, stabilisiert werden.
Eigenschaften
Wasserstoffperoxid-Harnstoff-Addukt ist ein gut wasserlöslicher, geruchloser, kristalliner Feststoff, der als weißes Pulver oder in farblosen Nadeln bzw. kleinen Plättchen[6] anfällt. Die Verbindung wirkt als starkes Oxidationsmittel brandfördernd und kann Hautreizungen und schwere Augenschäden verursachen.[4]
Das wasserfreie Harnstoffperoxohydrat setzt in Gegenwart von Katalysatoren bei Raumtemperatur in kontrollierter Weise Wasserstoffperoxid frei und eignet sich daher als sicherer Ersatz für die instabile wässrige Lösung von Wasserstoffperoxid. Wegen der Neigung zur thermischen Zersetzung, die sich bei Temperaturen über 82 °C beschleunigt,[5] sollte insbesondere reines Carbamidperoxid nicht über 60 °C erwärmt werden.
Anwendungen
Wie Wasserstoffperoxid findet auch Carbamidperoxid Verwendung als Bleichmittel, z. B. für das Blondieren von Haaren, für das Bleichen von Zähnen oder auch zum Fixieren von Haaren in Dauerwellen. Dabei ist das Wasserstoffperoxid-Harnstoff-Addukt weniger aktiv als flüssiges Wasserstoffperoxid, aber als Bleichmittel effektiver, da es nicht so alkalisch eingestellt werden muss wie H2O2.
Carbamidperoxid eignet sich auch als Desinfektionsmittel, z. B. zur Keimreduktion auf Kontaktlinsenoberflächen oder als Antiseptikum für Mundspülungen, Ohrentropfen oder für oberflächliche Wunden und Geschwüre.
Bei der Desodorierung wird die starke oxidative Wirkung des Wasserstoffperoxid-Harnstoff-Addukts, z. B. gegenüber Thiolen und Aminen ausgenutzt.
Carbamidperoxid hat sich als stabiles, einfach handhabbares, effektives und durch geeignete Wahl der Reaktionsbedingungen gut steuerbares Oxidationsmittel bewährt, das besonders in Gegenwart organischer Katalysatoren, wie z. B. Maleinsäureanhydrid[7] oder anorganischer Katalysatoren, wie z. B. Natriumwolframat[8] umweltfreundlich und in oft hohen Ausbeuten die entsprechenden Oxidationsprodukte liefert.
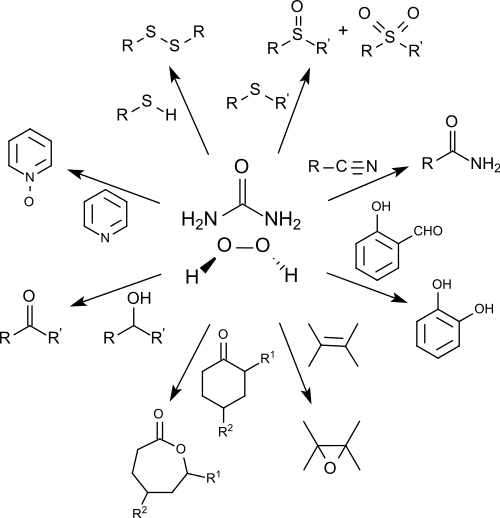
So werden Thiole selektiv zu Disulfiden[7], sekundäre Alkohole zu Ketonen[8], Sulfide zu Sulfoxiden und Sulfonen[9], Nitrile zu Amiden[10][9], N-Heterocyclen zu Aminoxiden[11][9],

aromatische Hydroxyaldehyde zu zweiwertigen Phenolen (Dakin-Reaktion)[12][9] und unter geeigneten Bedingungen weiter zu den entsprechenden Benzoesäuren[12],
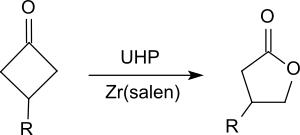
und Ketone zu Estern, insbesondere cyclische Ketone, wie z. B. substituierte Cyclohexanone[13] oder Cyclobutanone[14] zu Lactonen (Baeyer-Villiger-Oxidation) oxidiert.
Die Epoxidierung verschiedener Alkenen in Gegenwart von Benzonitril liefert Oxirane in Ausbeuten von 79 bis 96 %.[15]

Das auf das Alken übertragene Sauerstoffatom stammt aus der intermediär aus Benzonitril gebildeten Peroxoimidsäure. Die entstehende Imidsäure tautomerisiert zum Benzamid.
Einzelnachweise
- Eintrag zu UREA PEROXIDE in der CosIng-Datenbank der EU-Kommission, abgerufen am 22. Mai 2020.
- Datenblatt Hydrogen peroxide-urea bei AlfaAesar, abgerufen am 10. Mai 2016 (PDF) (JavaScript erforderlich).
- Datenblatt Urea hydrogen peroxide bei Sigma-Aldrich, abgerufen am 23. Oktober 2021 (PDF).
- Datenblatt Wasserstoffperoxid-Harnstoff zur Synthese (PDF) bei Merck, abgerufen am 10. Mai 2016.
- H. Heaney, F. Cardona, A. Goti, A.L. Frederick: Hydrogen Peroxide-Urea. In: e-EROS Encyclopedia of Reagents for Organic Synthesis. 2013, doi:10.1002/047084289X.rh047.pub3.
- C.-S. Lu, E.W. Hughes, P.A. Giguère: The crystal structure of the urea-hydrogen peroxide addition compound CO(NH2)2 H2O2. In: J. Am. Chem. Soc. Band 63, Nr. 6, 1941, S. 1507–1513, doi:10.1021/ja01851a007.
- B. Karami, M. Montazerozohori, M. H. Habibi: Urea-Hydrogen Peroxide (UHP) oxidation of thiols to the corresponding disulfides promoted by maleic anhydride as mediator. In: molecules. Band 10, Nr. 10, 2005, S. 1358–1363, doi:10.3390/10101385 (mdpi.org [PDF]).
- M. Lukasiewicz, D. Bogdal, J. Pielichowski: Microwave-assisted oxidation of alcohols using urea hydrogen peroxide. In: 8th International Electronic Conference on Synthetic Organic Chemistry. ECSOC-8. Abgerufen am 10. Mai 2016.
- R.S. Varma, K.P. Naicker: The Urea-Hydrogen Peroxide Complex: Solid-State Oxidative Protocols for Hydroxylated Aldehydes and Ketones (Dakin Reaction), Nitriles, Sulfides, and Nitrogen Heterocycles. In: Org. Lett. Band 1, Nr. 2, 1999, S. 189–191, doi:10.1021/ol990522n.
- Patent WO2012069948A1: 4-(5-Cyano-pyrazol-1-yl)-piperidine derivatives as GPR 119 modulators. Angemeldet am 9. November 2011, veröffentlicht am 31. Mai 2012, Anmelder: Pfizer Inc., Erfinder: V. Mascitti, K.F. McClure, M.J. Munchhof, R.P. Robinson, Jr..
- D. Rong, V.A. Phillips, R.S. Rubio, M.A. Castro, R.T. Wheelhouse: A safe, convenient and efficient method for the preparation of heterocyclic N-oxides using urea-hydrogen peroxide. In: Tetrahedron Lett. Band 49, Nr. 48, 2008, S. 6933–6935, doi:10.1016/tetlet.2008.09.124.
- H. Heaney, A.J. Newbold: The oxidation of aromatic aldehydes by magnesium monoperoxyphthalate and urea-hydrogen peroxide. In: Tetrahedron Lett. Band 42, Nr. 37, 2001, S. 6607–6609, doi:10.1016/S0040-4039(01)01332-6.
- M.Y. Rios, E. Salazar, H.F. Olivo: Baeyer–Villiger oxidation of substituted cyclohexanones via lipase-mediated perhydrolysis utilizing urea–hydrogen peroxide in ethyl acetate. In: Green Chem. Band 9, 2007, S. 459–462, doi:10.1039/B618175A.
- A. Watanabe, T. Uchida, K. Ito, T. Katsuki: Highly enantioselective Baeyer-Villiger oxidation using Zr(salen) complex as catalyst. In: Tetrahedron Lett. Band 43, Nr. 25, 2002, S. 4481–4485, doi:10.1016/S0040-4039(02)00831-6.
- L. Ji, Y.-N. Wang, C. Qian, X.-Z. Chen: Nitrile-promoted alkene epoxidation with urea-hydrogen peroxide (UHP). In: Synth. Commun. Band 43, Nr. 16, 2013, S. 2256–2264, doi:10.1080/00397911.2012.699578.