Baeyer-Villiger-Oxidation
Die Baeyer-Villiger-Oxidation ist eine Reaktion in der organischen Chemie. Dabei wird durch Umsetzung mit Percarbonsäure ein Keton zum Ester[1] umgesetzt:

Cyclische Ketone werden dabei unter Ringerweiterung in Lactone umgewandelt.[2] Die Reaktion wird durch die Gegenwart von Lewis-Säuren, z. B. BF3, katalytisch beschleunigt.
Die Baeyer-Villiger-Oxidation ist nach dem deutschen Chemiker Adolf von Baeyer (1835–1917) und dem Schweizer Chemiker Victor Villiger (1868–1934) benannt.
Reaktionsmechanismus
Eine besonders gut geeignete Percarbonsäure für die Baeyer-Villiger-Reaktion ist Peroxytrifluoressigsäure (2).[3]
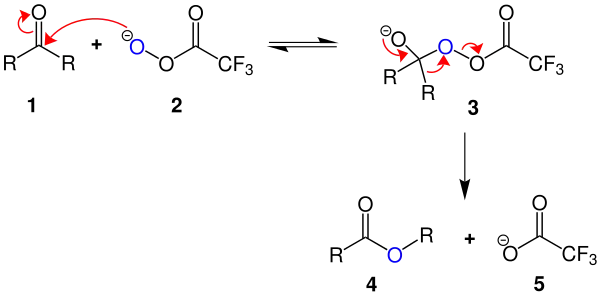
Das Keton 1 und die Percarbonsäure 2 reagieren unter Bildung des instabilen tetraedischen Zwischenprodukts 3 mit einer schwachen O-O-Bindung. Nach heterolytischer Spaltung der O-O-Bindung wandert eine der Alkylgruppen (oben: R) zu einem O-Atom.[4] Es entsteht ein Ester 4. Neben der katalytischen Beschleunigung durch Lewis-Säuren hat der Charakter der Abgangsgruppe [oben: Trifluoracetat (5)] und die „wandernde“ Gruppe einen wesentlichen Einfluss auf die Reaktionsgeschwindigkeit.
Bei unsymmetrisch substituierten Ketonen wandert im Allgemeinen die Gruppe, welche die positive Ladung des Carbeniumions besser stabilisieren kann, falls ihre Wanderung nicht sterisch gehindert ist.
Die relative Wanderungstendenz von der größten zur niedrigsten Wanderungstendenz:[3]
tert-Alkyl > sec-Alkyl = Phenyl > prim-Alkyl > Methyl
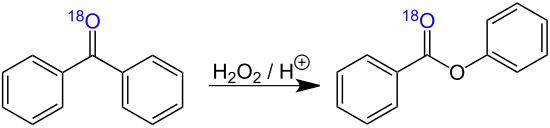
Experimentelle Untersuchungen der Baeyer-Villiger-Oxidation von 18O-markiertem Benzophenon zeigten, dass die Carbonylgruppe des Ketons unverändert im Endprodukt (Benzoesäurephenylester) erscheint:[5]
Aldehyde
Aldehyde werden in der Regel zu Carbonsäuren oxidiert, da ein H-Atom in den meisten Fällen die größte Wanderungstendenz zeigt (für Ausnahmen siehe Dakin-Reaktion). Diese Reaktion besitzt präparativ jedoch nur eine geringe Bedeutung, da es viele andere Methoden zur Oxidation von Aldehyden zu Carbonsäuren gibt, die einfacher und atomökonomischer realisierbar sind.
Technische Anwendung
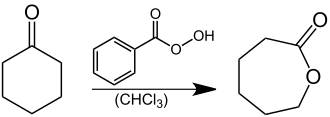
Caprolacton, ein Grundstoff zur Herstellung von Polycaprolacton einem Kunststoff aus der Gruppe der Thermoplaste, kann technisch durch eine Baeyer-Villiger-Oxidation von Cyclohexanon mit Persäuren, wie Peressigsäure,[6] Perbenzoesäure[7] oder m-Chlorperbenzoesäure[8] hergestellt werden. Die Oxidation kann jedoch auch mittels Katalysatoren durch Sauerstoff bewerkstelligt werden.[9][10] Im Labor benutzt man Perbenzoesäure als Oxidationsmittel:[2]
Enzymatische Variante
Die Verwendung von Baeyer-Villiger-Monooxygenasen (BVMO) erlaubt die enantioselektive Synthese von chiralen Lactonen, wobei die Subklasse der Cyclohexanon-Monooxygenasen (CHMO) sich als besonders effektiv erwiesen hat. So kann z. B. 4-Methylcyclohexanon enantioselektiv (> 96 % ee) zu (S)-4-Methyl-ε-caprolacton oxidiert werden. Der Mechanismus der enzymatischen Baeyer-Villiger-Reaktion wurde näher untersucht.[11]
Weblinks
Einzelnachweise
- Siegfried Hauptmann: Organische Chemie. 2. durchgesehene Auflage, VEB Deutscher Verlag für Grundstoffindustrie, Leipzig 1985, ISBN 3-342-00280-8, S. 366.
- Heinz G. O. Becker, Werner Berger, Günter Domschke, Egon Fanghänel, Jürgen Faust, Mechthild Fischer, Fritjof Gentz, Karl Gewald, Reiner Gluch, Roland Mayer, Klaus Müller, Dietrich Pavel, Hermann Schmidt, Karl Schollberg, Klaus Schwetlick, Erika Seiler, Günter Zeppenfeld: Organikum. 19. Aufl. Johann Ambrosius Barth, 1993, ISBN 3-335-00343-8.
- Paula Yurkanis Bruice: Organische Chemie. 5. Aufl. Pearson Education, 2007, ISBN 978-3-8273-7190-4, S. 831.
- Paula Yurkanis Bruice: Organische Chemie. 5. Aufl. Pearson Education, 2007, ISBN 978-3-8273-7190-4, S. 831–832.
- Ivan Ernest: Bindung, Struktur und Reaktionsmechanismen in der organischen Chemie. Springer, 1972, ISBN 3-211-81060-9, S. 258.
- Paul S. Starcher, Benjamin Phillips: Synthesis of Lactones. In: Journal of the American Chemical Society. 80, Nr. 15, 1958, S. 4079–4082, doi:10.1021/ja01548a063.
- S. L. Friess: Reactions of Per Acids. II. The Reaction of Perbenzoic Acid with Simple Cyclic Ketones. Kinetic Studies. In: Journal of the American Chemical Society. 71, Nr. 7, 1949, S. 2571–2575, doi:10.1021/ja01175a093.
- Sonia Horvat, Panagoitis Karallas, Jonathan M. White: Reactions of β-trimethylstannylcyclohexanones with peracids: investigations into the stannyl-directed Baeyer–Villiger reaction. In: Journal of the Chemical Society, Perkin Transactions 2. Nr. 10, 1998, S. 2151–2154, doi:10.1039/a804427i.
- Carsten Bolm, Gunther Schlingloff, Konrad Weickhardt: Use of molecular oxygen in the Baeyer-Villiger oxidation the influence of metal catalysts. In: Tetrahedron Letters. 34, Nr. 21, 1993, S. 3405–3408, doi:10.1016/S0040-4039(00)79167-2.
- Shun-Ichi Murahashi, Yoshiaki Oda, Takeshi Naota: Fe2O3-catalyzed baeyer-villiger oxidation of ketones with molecular oxygen in the presence of aldehydes. In: Tetrahedron Letters. 33, Nr. 49, 1992, S. 7557–7560, doi:10.1016/S0040-4039(00)60823-7.
- Iakov Polyak, Manfred T. Reetz, Walter Thiel: Quantum Mechanical/Molecular Mechanical Study on the Mechanism of the Enzymatic Baeyer–Villiger Reaction. In: Journal of the American Chemical Society. 134, Nr. 5, 2012, S. 2732–2741, doi:10.1021/ja2103839.