Cyclobutanon
Cyclobutanon ist ein Vierring-Keton und in der homologen Reihe der cyclischen Ketone (Cycloalkanone) das zweite Glied. Im Gegensatz zum Cyclopropanon, dem kleinsten, aber äußerst unbeständigen cyclischen Keton, ist Cyclobutanon eine bei Raumtemperatur stabile, lagerfähige Flüssigkeit, die destilliert werden kann.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Cyclobutanon | |||||||||||||||
| Summenformel | C4H6O | |||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 70,09 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||
| Dichte |
0,9547 g·cm−3 (0 °C)[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
99,75 °C[2] | |||||||||||||||
| Löslichkeit |
löslich in Wasser, Diethylether, Benzol, Chloroform und Toluol[1] | |||||||||||||||
| Brechungsindex |
1,4215 (20 °C)[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Geschichte und Darstellung
Der russische Chemiker Nikolai Kischner berichtete im Jahre 1905 erstmals über diese Substanz.[4] Er erhielt Cyclobutanon in geringer Ausbeute aus Cyclobutancarbonsäure in mehreren Reaktionsschritten. Das Syntheseverfahren ist nach heutigen Maßstäben umständlich und uneffektiv.
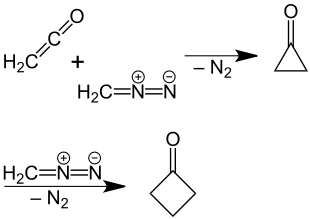
In der Folge wurden ergiebigere Synthesen ausgearbeitet.[5] Bei den älteren Verfahren handelt es sich um Abbaureaktionen von C5-Bausteinen. Zum Beispiel wurde die oxidative Decarboxylierung von Cyclobutancarbonsäure durch Einsatz anderer Reagenzien und Methoden verbessert. Ein neuer, aufbauender Weg zum Cyclobutanon wurde von P. Lipp und R. Köster gefunden, die eine Lösung von Diazomethan in Diethylether mit Keten reagieren ließen.[6] Diese Reaktion beruht auf einer Ringerweiterung des primär gebildeten Cyclopropanons, wobei molekularer Stickstoff abgespalten wird. Die Umsetzung ist jedoch mit Vorsicht durchzuführen, da Diazomethan explosiv ist; das gasförmige Keten muss in einer speziellen Apparatur erzeugt werden.[7] Der Reaktionsmechanismus konnte durch eine Umsetzung unter Verwendung von 14C-markiertem Diazomethan bestätigt werden.[8]
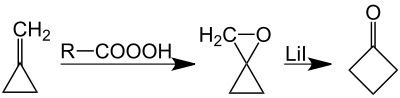
Die „beste Methode“ zur Synthese von Cyclobutanon soll die durch Lithiumiodid katalysierte Umlagerung von Oxaspiropentan sein, welches durch Epoxidierung aus dem leicht zugänglichen Methylencyclopropan entsteht:[9][10]
Seebachs Dithian-Methode und die solvolytische Cyclisierung von Butinyltriflat werden in Organic Synthesis als weitere synthetische Zugänge zu dem Vierringketon empfohlen.[11][12] Während Seebachs Synthese aufbauend ist (C3 + C1-Bausteine), repräsentieren die beiden anderen Verfahren Umwandlungen von C4-Bausteinen.[10][12]
Eigenschaften
Physikalische Eigenschaften
Cyclobutanon liegt bei Raumtemperatur als farblose Flüssigkeit vor. Der Siedepunkt unter Normaldruck liegt bei 99,75 °C.[2] Die entsprechende molare Verdampfungsenthalpie beträgt 38,2 kJ·mol−1.[2][13] Die Dampfdruckfunktion ergibt sich nach Antoine entsprechend log10(P) = A−(B/(T+C)) (P in bar, T in K) mit A = 5,00324, B = 1740,994 und C = −19,419 im Temperaturbereich von 249,1 bis 298,4 K.[14]
Chemische Eigenschaften
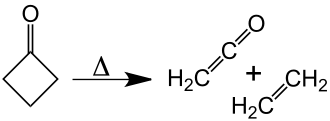
Auf ca. 350 °C erhitzter Dampf von Cyclobutanon (C4H6O) zerfällt in Ethen (C2H4) und Keten (H2C2O). Die Aktivierungsenergie für diese [2+2]-Cycloreversion beträgt 217,7 kJ·mol−1.[15] Die formal simple Retroreaktion, d. h. die [2+2]-Cycloaddition von Keten an Ethen, wurde nie beobachtet. Offenbar ist sie sehr viel langsamer als die Dimerisierung von Keten zu Diketen.
Verwendung
Cyclobutanon kann in der organischen Synthese im Labor als Ausgangsmaterial zur Herstellung anderer Cyclobutan-Derivate dienen. In der industriellen Chemie hat es vermutlich keine Bedeutung.
Einzelnachweise
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Physical Constants of Organic Compounds, S. 3-124.
- G. Wolf: Thermochemische Untersuchungen an cyclischen Ketonen, in: Helv. Chim. Acta 55 (1972) S. 1446–1459; doi:10.1002/hlca.19720550510.
- Datenblatt Cyclobutanone, 99 % bei Sigma-Aldrich, abgerufen am 4. August 2011 (PDF).
- N. Kishner: Über das Cyklobutanon, Journal der Russischen Physikalisch-Chemischen Gesellschaft, 37, S. 106–109 (1905); Über die Einwirkung von Brom auf die Amide α-bromsubstituierter Säuren, ibid. 37, S. 103–105 (1905), zitiert nach Chemisches Zentralblatt, 1905 I, 1220 bzw. 1219.
- Dieter Seebach: Isocyclische Vierringverbindungen in Houben-Weyl-Müller, Methoden der Organischen Chemie, Band IV/4, Georg Thieme Verlag, Stuttgart 1971.
- P. Lipp und R. Köster, Berichte der Deutschen Chemischen Gesellschaft, 64, S. 2823–2825 (1931).
- S. Kaarsemaker, J. Coops, Recueil des Travaux Chimiques des Pays-Bas, 70, S. 1033 (1951).
- D. A. Semenow, E. F. Cox, J. D. Roberts: Small-Ring Compounds. XIV. Radioactive Cyclobutanone from Ketene and Diazomethane-14C, in: J. Am. Chem. Soc., 78 (1956) S. 3221–3223, doi:10.1021/ja01594a069.
- J. R. Salaün, J. M. Conia: Oxaspiropentane. A Rapid Route to Cyclobutanone, Journal of the Chemical Society D: Chemical Communications, 1971, S. 1579b–1580; doi:10.1039/C2971001579B.
- J. R. Salaün, J. Champion, J. M. Conia: Cyclobutanone from Methylenecyclopropane via Oxaspiropentane In: Organic Syntheses. 57, 1977, S. 36, doi:10.15227/orgsyn.057.0036; Coll. Vol. 6, 1988, S. 320 (PDF).
- D. Seebach, A. K. Beck: Cyclic Ketones from 1,3-Dithiane: Cyclobutanone In: Organic Syntheses. 51, 1971, S. 76, doi:10.15227/orgsyn.051.0076; Coll. Vol. 6, 1988, S. 316 (PDF).
- M. Hanack, T. Dehesch, K. Humm, A. Nierth: Cyclobutanone In: Organic Syntheses. 54, 1974, S. 84, doi:10.15227/orgsyn.054.0084; Coll. Vol. 6, 1988, S. 324 (PDF).
- K. B. Wiberg, K. M. Morgan, H. Maltz: Thermochemistry of carbonyl reactions. 6. A study of hydration equilibria, in: J. Am. Chem. Soc., 116 (1994) S. 11067–11077; doi:10.1021/ja00103a024.
- S. W. Benson, G. B. Kistiakowsky: The Photochemical Decomposition of Cyclic Ketones, in: J. Am. Chem. Soc., 64 (1942) S. 80–86; doi:10.1021/ja01253a021.
- M. N. Das, F. Kern, T. D. Coyle und W. D. Walters: The Thermal Decomposition of Cyclobutanone, in: J. Am. Chem. Soc., 76, S. 6271–6274 (1954); doi:10.1021/ja01653a013.