Titan(IV)-sulfid
Titan(IV)-sulfid oder Titandisulfid ist eine chemische Verbindung aus der Gruppe der Sulfide mit der Formel TiS2.
| Kristallstruktur | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
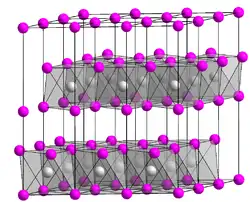 | ||||||||||||||||
| _ Ti4+ _ S2− | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Titan(IV)-sulfid | |||||||||||||||
| Verhältnisformel | TiS2 | |||||||||||||||
| Kurzbeschreibung |
grünes Pulver mit Geruch nach faulen Eiern[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 112,01 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte |
3,22 g·cm−3 [1] | |||||||||||||||
| Löslichkeit |
reagiert mit Wasser unter Freisetzung von Schwefelwasserstoff[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Darstellung
Titandisulfid kann aus Titantetrachlorid TiCl4 und Schwefelwasserstoff H2S hergestellt werden.[2]
Ebenfalls möglich ist die Synthese aus den Elementen.[3]
Eigenschaften
Titandisulfid ist ein bronzefarbenes, diamagnetisches kristallines Pulver.[2] Die Kristalle weisen eine Schichtstruktur auf, nämlich die Cadmiumiodid-Struktur.[2] Dabei sind die Schwefelatome in einer hexagonal dichtesten Kugelpackung angeordnet. Die Titanionen besetzen die Oktaederlücken zwischen jeder übernächsten Anionenschicht.
Die Verbindung ist gegenüber Feuchtigkeit empfindlich. Der Kontakt mit Wasser, vor allem aber wässrigen Säuren führt zur Hydrolyse und Bildung von Schwefelwasserstoff und Titandioxid.[4] Der Stoff ist aufgrund des Sulfidgehaltes brennbar, wobei Schwefeldioxid-Gas entsteht. Bei Raumtemperatur ist es luftbeständig, geht jedoch bei Erhitzen an Luft in Titandioxid über. Durch Salpetersäure sowie heiße konzentrierte Schwefelsäure wird es unter Schwefelabscheidung zersetzt. Von siedender Natron- und Kalilauge wird es unter Bildung von Alkalititanat und Alkalisulfid gelöst.[3]
Titandisulfid hat eine elektrische Leitfähigkeit, die einem Halbmetall entspricht, was bei der Verwendung in Batterien den Vorteil hat, dass keine Stoffe wie z. B. Ruß zur Erhöhung der Leitfähigkeit zugesetzt werden müssen.[5]
Titandisulfid kann (wie z. B. auch Graphit) in seine Schichtstruktur reversibel Lithium einlagern (Interkalation), wobei LixTiS2 entsteht, mit x zwischen 0 und 1. Es können auch N-Basen, wie NH3, N2H4, Säureamide eingelagert werden.[3]
Verwendung
Titandisulfid wird als festes Schmiermittel benutzt. Außerdem kann es als Elektrodenmaterial in Lithiumbatterien oder Lithium-Ionen-Akkumulatoren verwendet werden, wobei das niedrige Atomgewicht von Titan von Vorteil ist.
Einzelnachweise
- Datenblatt Titan(IV)-sulfid bei AlfaAesar, abgerufen am 23. August 2011 (PDF) (JavaScript erforderlich).
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 91.–100., verbesserte und stark erweiterte Auflage. Walter de Gruyter, Berlin 1985, ISBN 3-11-007511-3, S. 1065.
- Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band II, Ferdinand Enke, Stuttgart 1978, ISBN 3-432-87813-3, S. 1371.
- Eintrag zu Titan(IV)-sulfid bei ChemicalBook, abgerufen am 19. September 2011.
- M. S. Whittingham: Lithium Batteries and Cathode Materials, Chem. Rev. 104 (2004) 4273
